ضدعفونی کنندهها و گندزدا میبایست به روی طیف وسیعی از مخمرها، باکتریها، ویروسها و… موثر بوده و دارای اثر کشندگی بالا باشند. تصفیه فاضلاب صنعتی مواد ارگانیک مانند خلط، خون و آلاینده های متفاوت توسط ضدعفونی کنندهها سبب کاهش خطر آلاینده برای سلامتی انسان و محیط زیست میشوند. از آنجایی که ممکن است افراد با مصرف آب آلوده حاوی میکروارگانیسمهای بیماری زا، بیمار شوند، ضد عفونی و عقیم سازی آلایندهها فرایندی حائز اهمیت و ضروری است.

ازن ضد عفونی کننده قوی در تصفیه فاضلاب
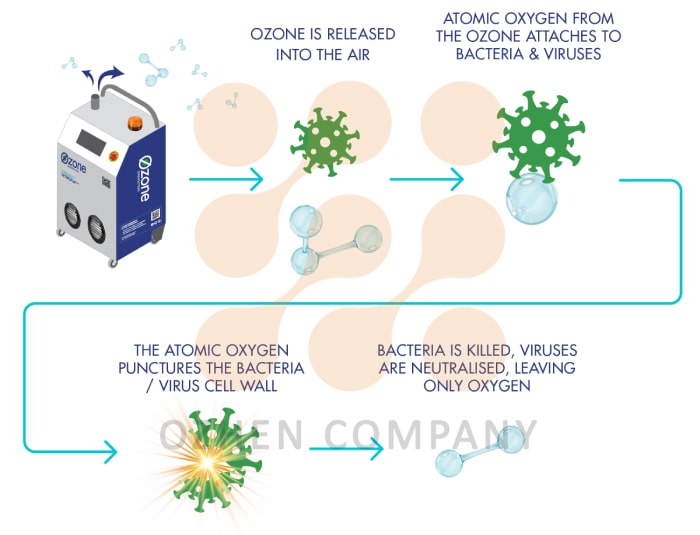
ازن از گاز حاوی اکسیژن (معمولاً هوای محیط یا اکسیژن خالص) تولید می شود. سپس گاز از یک میدان الکتریکی عبور می کند. هوا برای اطمینان از خشکی و عاری از ناخالصی های گرد و غبار، تصفیه می شود. اکسیژن در یک میدان الکتریکی به ازن تبدیل می شود. سپس ازن به مخزن تماس تزریق می شود تا ازن با استفاده از آب حل شود تا فرآیند ضد عفونی انجام گردد.

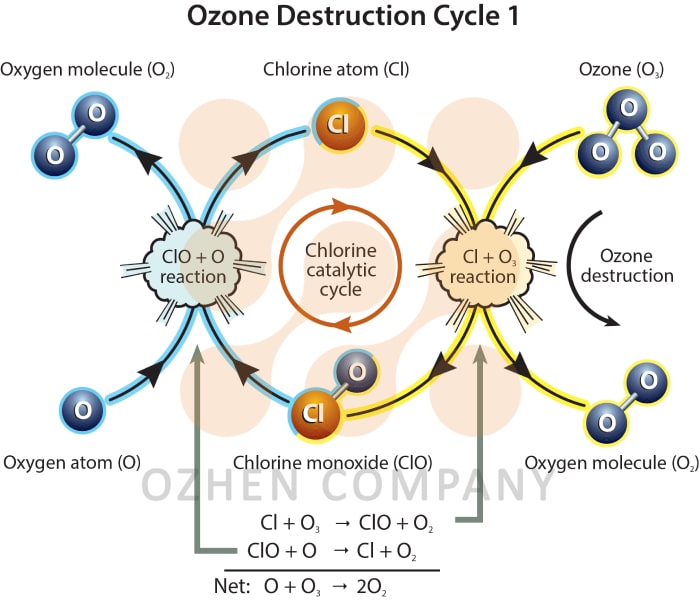
ازن یک فرمول آلوتروپیک (ناپایدار) اکسیژن است که در آن سه مولکول برای تولید یک مولکول جدید ترکیب می شوند. به سرعت رادیکالهای آزاد بسیار واکنش پذیر تجزیه میشوند. به علت پتانسیل اکسیداسیون ازن (-۲.۷V) بیشتر از کلر (-۱.۳۶V) یا یون هیپوکلریت (-۱.۴۹V)، این ماده به طور گسترده در تصفیهخانههای فاضلاب جهت اکسیدکنندگی مورد استفاده قرار میگیرد. ظرفیت اکسیداسیون ازن از رادیکال هیدروکسیل (• OH) و فلوراید بیشتر می باشد.
مزایای ضد عفونی کننده ازن
- • ازن قدرت اکسید کننده بالایی دارد.
- • زمان واکنش کوتاه لازم است بنابراین میکروب ها (از جمله ویروس ها) در چند ثانیه کشته می شوند.
- • هیچ تغییری در رنگ و طعم ایجاد نمی شود.
- • به هیچ ماده شیمیایی احتیاج ندارد.
- • اکسیژن اضافی پس از ضد عفونی کردن در آب تأمین می شود.
- • ساختار جلبک ها را متلاشی و آن ها را از بین می برد.
- • اکسید آهن و منگنز آب.
- • با همه مواد آلی واکنش نشان می دهد و آن ها را از بین می برد.
نحوه استفاده از ضد عفونی کننده ازن
ازن به صورت تولید در محل استفاده می شود زیرا ازن در فشار اتمسفر ناپایدار است و نمی توان آن را منتقل کرد. این ماده در غلظت های بالا سمی است زیرا نوعی گاز گلخانه ای محسوب می گردد. سه ماژول یک دستگاه ازن شامل تخریب کننده ازن ، محفظه تماس ازن و ژنراتور است. نور UV یا فرایند تخلیه تاج (Corona) برای تولید ازن استفاده میشود.
در محفظه تماس، ازن به آب اضافه می شود. هدف اصلی تخریب کننده محدود کردن مقدار ازن خارج شده در هوا است. سه فرآیند اصلی در تزریق ازن پس از وارد کردن ازن در آب حاصل می گردد: تجزیه، واکنش با ناخالصی های آب و سلب ورود به جو تجهیزات هستند.
این سیستم از ترکیبی از منبع اکسیژن و سیستم های برقی با قدرت بالا تشکیل شده است. جریان الکتریکی ولتاژ بالا بین الکترود و اکسیژن بین الکترودها تخلیه می شود. الکترودها با کمک شکاف دی الکتریک که شامل محفظه تخلیه برای جریان اکسیژن است از هم جدا می شوند.
میدان الکتریکی باعث تجزیه مولکول های اکسیژن شده و تشکیل اوزون رخ می دهد. پس از تولید، ازن به سمت محفظه تماس هدایت می شود، جایی که قرار است آب تصفیه شده ضد عفونی شود. مولکول های ازن تولید شده بلافاصله از هم جدا می شود بنابراین باید تولید ازن در محل انجام شود.

یکی از ویژگی های مهم زمان تماس ضدعفونی کننده نیز هست. بنابراین، درحالت های بالاست کردن و دبرستینگ مقادیر بسیار زیاد آب بالاست در سیستم های ضدعفونی کاملا مقرون به صرفه خواهد بود. در سیستم های تزریق ازن مخازن تماس مجهز به تجهیزات تزریق ازن است که به عنوان اتاق های تماس با آنها عمل می کند. برای دستیابی به مدت زمان تماس طولانی، آب بالاست باید در این مخازن تماس قرار گیرد. به منظور کاهش تشکیل رسوب و ذرات ریز برای ورود به فرآیند تصفیه ، ازن تصفیه باید تحت تصفیه مقدماتی (فیلتر یا سیکلون) قرار گیرد.
تصفیه بالادست اطمینان حاصل می کند که تمام آب موجود در مخازن بالادست هنگام ارسال جهت مصرف در معرض ازن قرار می گیرد. زمان تماس نقش مهمی در فرآیند ضد عفونی ایفا می کند. در صورت عدم تماس طولانی با میکروارگانیسم خاص، ضد عفونی تضمین نمی شود. اگر مدت زمان تماس طولانی در برابر میکروارگانیسم های خاص مورد نیاز باشد ، برای فعال کردن زمان تماس طولانی تر، باید کلرزنی نیز در طول مسیر انجام گردد.
کربنهای آلی با تشکیل رسوب همراه هستند. این رسوبات در انتهای مخازن بالاست در طول سفر مستقر می شوند. رسوبات حاوی میکروبهایی هستند که تصفیه آن مانند کلونی های باکتریایی یا توده های ویروسی دشوار است. تزریق ازن ممکن است در رسوب کارایی نداشته باشد.
آمونیاک ممکن است در نتیجه فعالیتهای بیولوژیکی ضدعفونی کننده ها در طول مسیر تولید شود. برم ها با واکنش آمونیاک و مواد ضدعفونی کننده باقیمانده تولید می شوند. برم ها ضدعفونی کننده های ضعیف تری هستند، بنابراین اثربخشی کاهش می یابد.
تولید ازن توسط دستگاه ازن ژنراتور
ازن با اعمال برق ولتاژ بالا در شکاف (لوله پلی اتیلن) حاوی اکسیژن خالص یا هوای خشک فیلتر شده (روش تخلیه تاج) تولید می شود.
اعمال ولتاژ بالا منجر به تشکیل ازن با نوترکیب اکسیژن می شود. واکنش به شرح زیر است:
ازن با اکسیداسیون دیواره های سلولی میکروارگانیسم ها، که سپس تجزیه می شود، میکروارگانیسم ها را از بین می برد. این مکانیسم بسیار متفاوت از کلر است که از طریق دیواره سلولی پراکنده می شود و سلول را مستعد حمله آنزیمی می کند.
پروکسان فعال در تجزیه آلایندهها با استفاده از فرآینذ اکسیداسیون
پروکسان به عنوان ترکیبی از ازن و پراکسید هیدروژن یک فرآیند اکسیداسیون جدید و پیشرفته است که می تواند برای تصفیه خاک های آلوده، آب های زیرزمینی و تصفیه فاضلاب استفاده شود. از پروکسان می توان به طور فعال برای تجزیه آلاینده ها مانند ترکیبات آلی فرار، حلال های کلرینه شده، مهمات، موتور دیزل، هیدروکربنه ای آلی فرار، هیدروکربن های آروماتیک چند هسته ای (PAH)، سایر هیدروکربن ها، بنزین، فلزات و TNT استفاده کرد.
همچنین در ضدعفونی کردن آب آشامیدنی قابل استفاده است. ضدعفونی کننده پروکسان به عنوان یک عامل اکسید کننده با فعالیت ضد باکتریایی و ضد ویروسی شناخته می شود که به رفع بوی بد و ضدعفونی کردن کمک می نماید. این ماده در زمینه های پزشکی، آرایشی و بهداشتی و همچنین صنایع غذایی کاربرد داشته، زیرا خاصیت میکروب کشی و ضدعفونی کنندگی پروکسان در سطحی بالا و قوی قرار دارد.

ساختار برجا مانده از مصرف این ضدعفونی کننده زیانی به محیط زیست نمی رساند، از همین رو نوعی ترکیب شیمیایی دوستدار محیط زیست به شمار می آید. با توجه به این که ضدعفونی کننده پروکسان یکی از قوی ترین و مؤثرترین مواد است، در بیمارستان و مراکز پزشکی با غلظت ۶% برای استریل کردن تمامی سطوح به کار می رود و پس از استفاده لزومی به شستشوی سطوح مختلف نیست.
پروسه پروکسان استفاده از ازون (O3) همراه با پراکسید هیدروژن (H2O2) می باشد. در طی این فرآیند ذرات بسیار پایدار تشکیل می شوند. به اصطلاح رادیکال هیدروکسی. (OH) این رادیکال ها با اکثر آلاینده های آلی در محلول واکنش نشان داده و یا اکسیده می شوند.

ایالات متحده و آلمان از پروکسان در فرآیند تهیه آب آشامیدنی برای از بین بردن رنگ، طعم و آلاینده ها مانند سموم دفع آفات از آب استفاده می کنند. افزودن پراکسید هیدروژن سبب تسریع از بین رفتن با ازن می شود و باعث افزایش غلظت رادیکال هیدروکسی می شود. نرخ خالص تولید رادیکال هیدروکسی آزاد خالص ۱ مول در هر مول ازن است.
مواد تشکیل دهنده پروکسان
ضدعفونی کننده پروکسان که کاربردهای گسترده ای در زمینه های گوناگون دارد، طی فرآیند سنتزی از ترکیب موادی مانند پروکسی استیک اسید، آب اکسیژنه یا هیدروژن پراکسید، استیک اسید، HEDP، آب مقطر یا دیونیزه و سایر مواد افزودنی حاصل می شود. شیوه تولید، اثرات و استفاده از ضدعفونی کننده پروکسان توسط سازمان های FDA و EPA تأیید شده است.
نحوه اکسیداسیون پروکسان توسط ازن مایع
اکسیداسیون پروکسان می تواند از دو طریق انجام شود:
- اکسیداسیون مستقیم مواد توسط ازن مایع (O3-aq)
- اکسیداسیون ترکیبات توسط رادیکال های هیدروکسی تولید شده در هنگام تجزیه ازن
هر دو واکنش اکسیداسیون از همین مواد استفاده می کنند. اکسیداسیون مستقیم توسط ازن مولکولی یک فرآیند نسبتاً کند در مقایسه با اکسیداسیون توسط رادیکال های هیدروکسی است. با این حال، غلظت ازن زیاد است. رادیکال های هیدروکسی (Hydroxyradicals) به سرعت واکنش نشان می دهند، اما غلظت آن ها در شرایط عادی نسبتاً کم است.
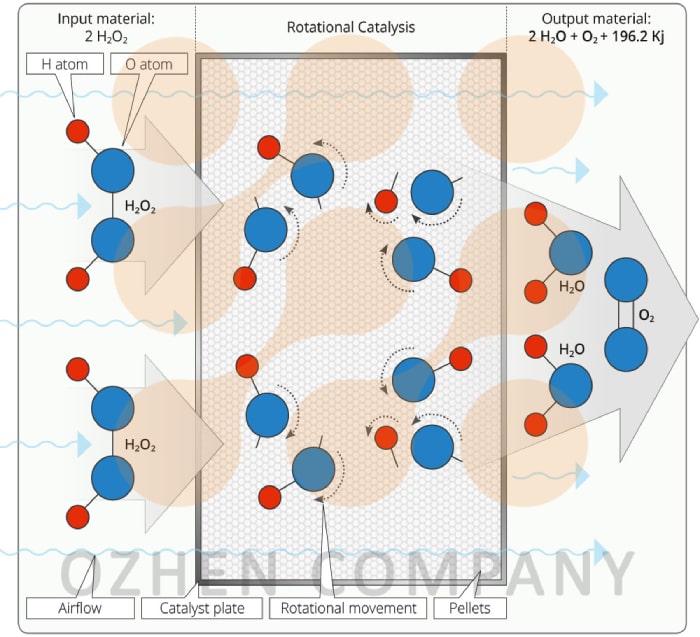
پروسه پروکسان عمدتاً به پتانسیل رادیکال هیدروکسی بستگی دارد. هنگامی که فرآیند پروکسان انجام می شود، مانده ازن کمی باقی مانده است. پراکسید که در طی فرآیند اضافه می شود، تجزیه ازن را تقویت می کند. اکسیداسیون پروکسان فرآیندی سریعتر و واکنش پذیرتر از ازوناسیون است. پتانسیل اکسیداسیون رادیکال هیدروکسی و ازن به شرح زیر است:
موارد استفاده از ماده پروکسان در نابودسازی ترکیبات آلی
اکسیداسیون توسط رادیکال های آزاد بسیار مؤثرتر از اکسیداسیون ازن است. در نتیجه، پروکسان به طور گسترده ای برای از بین بردن ترکیبات آلی مانند عطر، طعم و بو و ترکیبات آلی کلر دار استفاده می شود که اکسیداسیون بسیار مشکلی دارند. نه ازن و نه پروکسان از کل کربن آلی (TOC) موجود در آب کاهش نمی دهند.
پروکسان ترکیبات آلی اشباع شده را اکسید می کند و فرآورده های جانبی را که شبیه محصولات جانبی ضدعفونی کننده ازن هستند مانند آلدهیدها، کتون ها، پراکسیدها، یون های برم و ترکیبات ارگانیک تخریب پذیر تولید می کنند. مکانیسم واکنش پروکسان بر اساس پراکسید هیدروژن و واکنش ازن ساخته شده است و رادیکال های هیدروکسی (OH-)را تشکیل می دهد. این ترکیبات پایدار و تحت واکنشی آلاینده های آلی موجود در آب را اکسیده می کنند.
تولید ماده پروکسان توسط فرآیند رادیکالی
مانند فرآیند ضد عفونی ازن، اثر فرآیند ضد عفونی پروکسان توسط pH و بی کربنات قلیایی تعیین می شود. هر دو بی کربنات و کربنات هنگامی که قلیایی زیاد است با هیدروکسی رادیکال واکنش نشان می دهند. مقادیر بیش از حد پراکسید می تواند تشکیل هیدروکسی رادیکال را محدود کرده و می تواند اثر پروکسان را کاهش دهد.
اکسیداسیون با ازن مولکولی به آرامی اتفاق می افتد اما اکسیداسیون با رادیکال های هیدروکسیل بسیار سریع رخ می دهد. قرار گرفتن در معرض رادیکال هیدروکسیل تابعی از دما، pH، قلیایی، غلظت و ترکیب ماده آلی طبیعی (NOM) است. قرار گرفتن در معرض رادیکال هیدروکسیل با افزایش دما، pH و قرار گرفتن در معرض NOM افزایش می یابد (به عنوان مثال، تجزیه NOM با ازن سرعت به کمک تشکیل رادیکال هیدروکسیل را افزایش می یابد) و با افزایش قلیایی رادیکال های هیدروکسی کاهش می یابد.

برخی از سطح اکسیداسیون می تواند به طور طبیعی در ازن انجام شود (بدون افزودن پراکسید). با این حال، در سیستم های O3/H2O2، قرار گرفتن ضدعفونی کننده در معرض رادیکال هیدروکسیل به طور قابل توجهی نسبت به اوزوناسیون معمولی بالاتر است. (۱۰۰ برابر بیشتر)
پروکسان به عنوان ماده ای اکسیدان و یا اکسید کننده مصرف می شود که نحوه عملکرد آن از طریق تأثیر بر روی غشای سلول های زنده و ماده ژنتیکی ویروس ها و میکروب های بدون پوشش است. همچنین ترکیب پروکسان با اتانول و ایزوپروپیل برای کشتن کلیه باکتری ها و ویروس ها کاربرد دارد به صورتی که از ترکیب نمودن ضدعفونی کننده پروکسان با اتانول می توان باکتری ها و ویروس های فاقد غشا را از بین برد و از ترکیب آن با ایزوپروپیل هم امکان از بین بردن باکتری و ویروس های غشادار فراهم می آید.
محلول پروکسان را می توان با نسبت ۱ به ۵۰۰ پروکسان و آب برای ضدعفونی کردن سطوح در مکان های عمومی و با تناسب ۱ به ۲۵۰ برای ضدعفونی کردن اتاق عمل استفاده نمود. قدرت ضدعفونی کنندگی پروکسان به اندازه ای بالا است که تنها در طول ۷ تا ۱۰ دقیقه اثرگذاری کامل دارد و پس از گذشت ۳۰ ثانیه خشک می شود.
کاربرد ضدعفونی کننده پروکسان در مخزن ازن
کارآمدترین کاربرد عملیاتی O3/H2O2 اضافه کردن پراکسید در مرحله دوم کار (به عنوان مثال فرآیند پروکسان) با تزریق آن به محفظه دوم یک مخزن اسید تماس ازن است. این ترتیب این امکان را می دهد تا مزایای ضدعفونی کننده ازن را بدست آورد و در عین حال از مزایای فرآیند اکسیداسیون پیشرفته (AOP) برای از بین بردن میکروآلاینده ها جلوگیری کند. اکسیداسیون با AOP (advanced oxidation process) واکنش پذیرتر و سریعتر است و در تصفیه فاضلاب و از بین بردن طعم و بو و میکرو آلودگی های آلی که فقط با ازن دشوار است، مؤثر است.

در روش ، ضدعفونی کننده H2O2 به عنوان یک محلول آبی، در مقادیر آب اکسیژنه به ازن بین ۰.۲ تا ۳.۰ تغذیه می شود. نسبت بهینه برای از بین بردن بیشتر ترکیبات از ۰.۳ تا ۰.۶ متغیر است. نسبت خاص تابعی از الزامات ضد عفونی، غلظت برمید، غلظت آلاینده ها و سایر پارامترهای کیفیت آب است. انتظار می رود فرآورده های فرعی عمده تولید شده توسط فرآیندهای AOP مشابه محصولات تولید شده توسط ازن تنها باشند.
هر دو فرآیند ازن و AOP در حضور NOM و برمید، برومات تشکیل می دهند. هنگامی که فرآیندهای متعارف ازن با AOP جایگزین می شود، اگر بقایای O3 ثابت بماند (به دلیل بالاتر · OH و دوز O3 بالاتر) ، می تواند تشکیل بروم افزایش یابد و در صورت کاهش دوز ازن کاهش یابد.
شرایط نگهداری پروکسان و جلوگیری از بروز خطرات جانبی
شرایط نگهداری پروکسان و عمل به آن هم برای حفظ قدرت پاک کنندگی و ضدعفونی کنندگی آن و هم برای جلوگیری از بروز خطرات جانبی بسیار حائز اهمیت است. محیط نگه داری باید دارای تهویه مناسب باشد و دمای محیط ذخیرهسازی ضدعفونی کننده پروکسان نباید بیش از ۳۰ و کمتر از ۱۵ درجه سانتی گراد باشد چرا که در دماهای بالاتر به سرعت تجزیه شده و در دماهای پایینتر سفت و فازهای آن از یکدیگر جدا می شوند.
به تاریخ انقضای آن نیز باید توجه داشت. علاوه بر این ظروف ضدعفونی کننده پروکسان حتما باید به صورت ایستاده و به سمت بالا قرار گیرند.

مشخصات شیمیایی و فیزیکی پروکسان
ضدعفونی کننده پروکسان کاملا بی رنگ است و در غلظت های بالا بوی بسیار تندی خواهد داشت که به سرکه شباهت دارد. معمولا در محیط های بیمارستانی و درمانی که غلظت های بالای این ماده مورد نیاز است، بو به طور محسوس استشمام خواهد شد. در مصارف خانگی ضدعفونی کننده پروکسان بویی ندارد و یا شدت بوی آن به دلیل غلظت پایینتر به مراتب کمتر است.
در غلظت های بالا از ضدعفونی کننده پروکسان اسیدیته آن به ۱ تا ۱.۵ می رسد که بسیار قوی بوده و به ماده ای کشنده تبدیل می شود و باید در موقع مصرف نیز بسیار با احتیاط عمل نمود. پروکسان در غلظت های پایینتر مثل ۵.۵ یا حتی ۸ نیز قدرت ضدعفونی کنندگی خود را دارد اما برای مواردی که از درجه اهمیت پایین تری دارند، به کار می رود.
این ضدعفونی کننده در حضور مواد آلی قدرت پاک کنندگی خود را از دست نمی دهد و در صورتی که بر روی سطوح مقداری کمی مواد قلیایی به کار رفته باشد اثر چندانی بر روی آن نخواهد داشت چرا که به عنوان ضدعفونی کننده اسید شناخته شده است.

نکات فنی و ایمنی هنگام استفاده از پروکسان
هنگام مصرف محلول ضدعفونی کننده پروکسان حتما باید دستکش مقاوم به مواد شیمیایی و ماسک مناسب به همراه داشت. از برخورد این ماده با سطوح فلزی باید خودداری شود چرا که حتی در غلظت پایین نیز اسیدیته قابل توجهی داشته و کاملا خورنده است. در صورتی که با دست یا چشم برخورد پیدا کند، بلافاصله با آب فراوان محل مورد نظر را شستشو داده و در صورتی عدم بهبودی سوزش چشم باید به پزشک مراجعه نمود.
ضدعفونی کننده پروکسان از لحاظ آسیب و خطراتی نظیر بلعیدن و یا تنفس کردن نیز در طی آزمایش های مختلف سنجیده شده و در صورتی که به اشتباه بلعیده شود خطر ۵ از ۱۰، تنفس بوی آن خطر ۵ از ۱۰ و تماس آن با چشم و پوست نیز خطر ۴ از ۱۰ دارد.
هنگام استفاده از این محول ضدعفونی کننده به هیچ وجه نباید آن را با مواد کاهنده نظیر آمین ها، ترکیبات فلزی سنگین مثل خشک کننده ها و تسریع کننده ها ترکیب کرد چرا که اشتباه بزرگ بسیاری از کسانی که آشنایی و اطلاعات کافی ندارند بوده و تصور دارند با این کار قدرت آن افزایش می یابد و یا بر روی سطوحی که قبلا این مواد ریخته شده استفاده میکنند در صورتی که باید محیط از وجود چنین مواد شیمیایی پاک گردد و بعد از پروکسان استفاده کرد در غیر این صورت گاز متصاعد شده به شدت سمی خواهد بود.

موارد منع مصرف ماده شیمیایی پروکسان
در مورد منع مصرف ضدعفونی کننده پروکسان ذکر شده که از خوردن و استنشاق بوی آن شدیداً خودداری شود و در صورتی که برچسب اطلاعات آن کنده شده حتما از طریق تست شیمیایی برای تشخیص آن استفاده گردد. به هیچ عنوان نباید از برای ضدعفونی کنندگی و یا پاک کردن چرک و زخم باز مصرف شود.
فوتوکالیست تولید شده توسط رادیکال های آزاد
شتاب باریکه نوری در حضور یک کاتالیزور به عنوان فوتوکاتالیز گفته می شود. در فوتولیز کاتالیز شده، از بستر جاذب برای جذب نور استفاده می شود. در کاتالیز تولید شده توسط فوتوکس ، جفت های سوراخهای الکترونی با فعالیت فوتوکاتالیستی (PCA) تولید رادیکال های آزاد (به عنوان مثال، رادیکالهای هیدروکسیل) و (•OH) ایجاد می شوند که توانایی انجام واکنش های ثانویه را دارند. کاربرد عملی آن با کشف الکترولیز آب با استفاده از دی اکسید تیتانیوم امکانپذیر شد.
واکنش فوتوکاتالیز به متریال نیمه هادی
واکنش فوتوکاتالیستی عمدتا به انرژی (فوتون) با طول موج مشخص و کاتالیزور بستگی دارد. عموماً از متریال نیمه هادی به عنوان کاتالیزور استفاده می شود. این مواد به دلیل ساختار الکترونیکی خود به عنوان تشدیدکننده در تابش فرآیند ردوکس ایجاد شده از نور عمل می کنند. این مواد یک باند پر از ظرفیت و یک گروه هدایت خالی دارند.
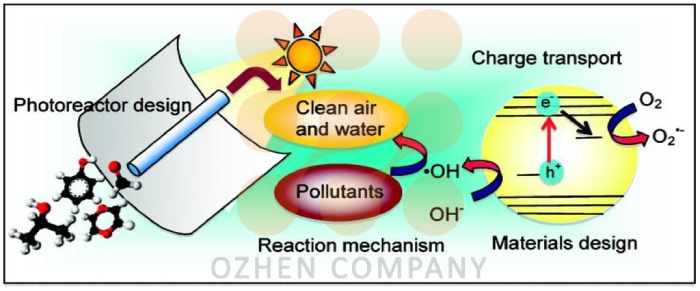
فرآیند تبدیل فوتوکاتالیز نیمه هادی
- هنگامی که انرژی نور از نظر فوتون روی سطح یک نیمه رسانا قرار می گیرد، اگر انرژی اشعه حادثه معادل یا بیشتر از انرژی پهنای باند نیمه هادی باشد ، الکترون های باند ظرفیت به سمت باند رسانای نیمه هادی حرکت می کنند.
- در باند ارزش نیمه هادی ها حفره هایی باقی مانده است.این حفره ها می توانند با مولکولهای آب واکنش نشان دهند و رادیکالهای هیدروکسیل را با اکسیداسیون مولکولهای اهداکننده تولید کنند.
- یون های سوپراکسید با واکنش با الکترون های باند انتقال با گونه های اکسیژن محلول تشکیل می شوند.این الکترونها واکنشهای ردوکس را القا می کنند.
- این الکترون ها و حفره ها ممکن است تحت تأثیر واکنش های ردوکس پی در پی با بسیاری از گونه ها قرار گیرند تا با جذب سطح نیمه هادی ، محصولات لازم را شکل دهند.
مزایای ضدعفونی کننده فوتوکالیست
- فوتوکاتالیز از ظرفیت انرژی خورشیدی قابل تجدیدپذیر و بدون آلودگی استفاده می کند، بنابراین جایگزینی مناسب برای روش های تصفیه مرسوم با انرژی فشرده است.
- در مقایسه با روشهای تصفیه مرسوم ، فوتوکاتالیز منجر به تشکیل ترکیبات بی ضرر می شود.
- فاضلاب حاوی ترکیبات خطرناک مختلفی است. فرآیند فوتوکاتالیستی باعث از بین رفتن طیف گسترده ای از این ترکیبات خطرناک در جریان های مختلف فاضلاب می شود.
- واکنش ها در این فرآیند خفیف است. ورودی شیمیایی کمتری مورد نیاز است و زمان واکنش متوسط است.
- می تواند در تولید هیدروژن ، فاز گازی و تیمارهای آبی و همچنین برای مراحل فاز جامد (خاک) اعمال شود.
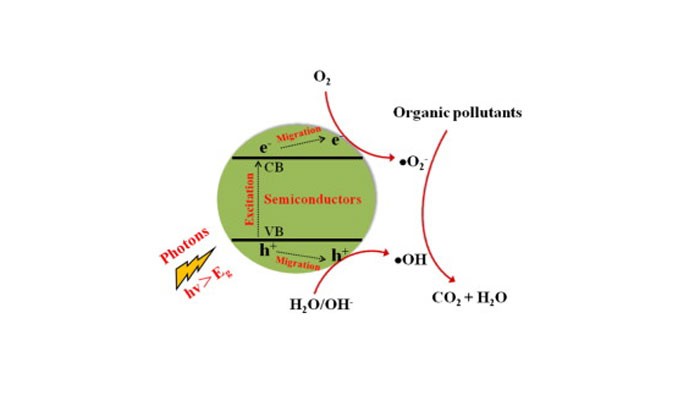
کاربرد ضدعفونی کننده TiO2 در تصفیه فاضلاب
برای کاربرد مؤثر TiO2 در تصفیه آب و فاضلاب، محدودیت انتقال جرم باید به حداقل برسد زیرا تخریب فوتوکاتالیستی به طور عمده در سطح TiO2 رخ می دهد. TiO2 میل کمتری نسبت به آلاینده های آلی (به طور خاص آلاینده های آلی آبگریز) دارد بنابراین جذب آلاینده های آلی روی سطح TiO2 کم است که منجر به نرخ تخریب فوتوکاتالیستی کند می شود.
بنابراین ، هدف قرار دادن آلاینده ها در اطراف نانوذرات TiO2 برای افزایش راندمان فوتوکاتالیستی نیاز به توجه دارد. علاوه بر این ، نانوذرات TiO2 ممکن است به دلیل بی ثباتی ذرات نانوسیمی تجمع یابد که ممکن است مانع از بروز نور در مراکز فعال و در نتیجه کاهش در فعالیت کاتالیزوری شود.
با این حال ، باید توجه داشت که ممکن است که ذرات کوچک پراکندگی بالاتری را نشان دهند ، که می تواند فعالیت فوتوکاتالیستی آنها را در مقایسه با ذرات بزرگتر کاهش دهد. علاوه بر این ، برای سیستم دوغاب، یکی از چالش های اصلی این است که ذرات TiO2 نانوسیم شده از آب تصفیه شده را از نظر مسائل اقتصادی و ایمنی بازیابی کنید.
راهکار استفاده از فوتوکاتالیز مبتنی بر TiO2
- اصلاح کاتالیزور TiO2، به منظور دستیابی به استفاده از نور مرئی.
- سنتز کاتالیزور برای به دست آوردن کاتالیزورها با ساختار کریستالی تعریف شده ، میل زیاد به آلاینده های مختلف آلی و اندازه ذرات کوچکتر باید بهینه شود.
- توسعه و طراحی نسل دوم کاتالیزور TiO2 ، با قابلیت جداسازی بالا ، که می تواند به صورت مؤثر بازیابی و بازسازی شود.
- هدف از این اصلاحات و پیشرفت ها ، بهبود بهره وری فوتوکاتالیستی ، تخریب کامل آلاینده های آلی ، بهبود جذب نور مرئی ، بهبود ثبات و تکرارپذیری ، و بهبود توانایی های بازیافت و استفاده مجدد از TiO2 است.
برای غلبه بر محدودیت های فوتوکاتالیز مبتنی بر TiO2، اقدامات متقابل زیر در مطالعات قبلی اتخاذ شده است اصلاح کاتالیزوربه منظور دستیابی به استفاده از نور مرئی سنتز کاتالیزور برای به دست آوردن کاتالیزورها با ساختار کریستالی تعریف شده ، میل زیاد به آلاینده های مختلف آلی و اندازه ذرات کوچکتر باید بهینه شود.
توسعه و طراحی نسل دوم کاتالیزور، با قابلیت جداسازی بالا، که می تواند به صورت مؤثر بازیابی و بازسازی شود هدف از این اصلاحات و پیشرفت ها، بهبود بهره وری فوتوکاتالیستی، تخریب کامل آلاینده های آلی، بهبود جذب نور مرئی، بهبود ثبات و تکرارپذیری و بهبود توانایی های بازیافت و استفاده مجدد از ماده نیمه هادی است که به عنوان یک ماده اکسید کننده قوی در هنگام تابش با کاهش انرژی فعال سازی مورد نیاز برای تجزیه ترکیبات آلی و معدنی عمل می کند.
برای تولید این دو حامل، مقدار کافی از انرژی باید توسط یک فوتون تأمین شود تا یک الکترون به باند انتقال منتقل شود، بنابراین یک حفره در مقایسه با مواد رسانا ، نوترکیب حفره ها و الکترون ها در نوترکیب در فلزات که نسبتاً کند است، با سرعت بسیار بیشتری رخ می دهد.
هیپوکلریت سدیم در تولید سفید کننده صنعتی و خانگی
افزایش تقاضای سفیدکننده خانگی (سدیم هیپوکلریت) بیشتر از رشد جمعیت ناشی می شود. به نوبه خود، رشد جمعیت و افزایش مربوط به آن در مصرف آب – همراه با منابع محدود آب شیرین- تصفیه آب را به بزرگترین کاربرد سفید کننده و همچنین سریعترین بخش استفاده از سفید کننده تبدیل می کند. هیپوکلریت سدیم (NaClO) ماده مؤثر در سفید کننده کلر، یک اکسید کننده و ماده سفید کننده قوی است.
تولید شیمیایی هیپوکلریت سدیم یک فرآیند شناخته شده در صنعت می باشد و پیشینه عملکرد آن نیز برای جلوگیری از انتشار کلر در گیاهان کلر-قلیایی به کار می رود. این فرایند شیمیایی به دستیابی کلر و سود سوز آور (NaOH) از منابع خارجی متکی است.
در مقابل با فرآیند الکتروشیمیایی برای تولید سفید کننده که شامل الکترولیز آب نمک است. فرآیند کلر زدن سود سوز آور در هیپوکلریت سدیم یک واکنش گرمایی است. فرآیند تولید مواد شیمیایی روشی است که به طور گسترده مورد استفاده قرار می گیرد. (مانند فرآیند استفاده شده توسط Solvay Chemicals (بروکسل، بلژیک-www.solvay.com)
این فرایند برای تولید هر دو نوع سفید کننده خانگی (۵-۶ درصد وزنی) و سفید کننده صنعتی (۱۰ تا ۱۵ درصد وزنی) مناسب است.
استفاده از سدیم هیپوکلریت در تصفیه و کاهش بو در فاضلاب صنعتی
از سدیم هیپوکلریت برای ضد عفونی کردن استخرهای شنا استفاده می شود. سفیدکننده در واقع ترکیبی از مواد شیمیایی است، ماده اصلی تشکیل دهنده آن محلول هیپوکلریت سدیم ۳-۶٪ (NaOCl) است که با مقادیر کمی هیدروکسید سدیم، هیدروژن پراکسید و هیپوکلریت کلسیم مخلوط می شود.
کاربرد اصلی آن از بین بردن رنگ، سفیدتر کردن یا ضد عفونی کردن لباس یا سطوح است و در بیشتر آشپزخانه ها و حمام های مدرن بسیار ارزشمند است. هیپوکلریت سدیم در مقیاس عظیم در کشاورزی مورد استفاده قرار می گیرد و صنایعی مانند مواد شیمیایی، رنگ، آهک، مواد غذایی، شیشه، کاغذ، داروسازی، مصنوعی و دفع و تصفیه فاضلاب و زباله نیز مورد استفاده قرار می گیرد.
سدیم هیپوکلریت اغلب برای کاهش بو به فاضلاب صنعتی اضافه می شود، زیرا NaOCl H2S و آمونیاک را خنثی میکند. همچنین برای سمزدایی حمامهای سیانید مورد استفاده در فرآیندهای آبکاری فلز و جلوگیری از رشد جلبک و صدف در برجهای خنککننده و تصفیه آب استخرها مورد استفاده قرار میگیرد.
هیپوکلریت سدیم یا آب ژاول یک پودر سفید است که در آب حل می شود تا یک محلول کمی زرد رنگ و با بوی مشخص ارائه دهد. غلظت های مختلف هیپوکلریت سدیم از نظر اثر سفید کننده آن ها دارای قدرت های مختلفی است. برای مصارف خانگی معمولاً سفیدکننده حاوی ۵٪ هیپوکلریت سدیم است و pH آن را به ۱۱ می دهد و باعث تحریک ملایم پوست می شود. سفید کننده غلیظ (۱۰-۱۵٪ هیپوکلریت سدیم) بسیار قلیایی است (۱۳ pH) و در حال حاضر به قدری خورنده است که می تواند در تماس با آن پوست را سوزاند.
کاشف سدیم هیپوکلریت یا همان آب ژاول
مواد سفید کننده مایع بر اساس هیپوکلریت سدیم در سال ۱۷۸۵ توسط فرانسوی کلود لوئیس برثولت (Claude Louis Berthollet) ساخته شد. سپس توسط شرکت ژاول تحت نام آب ژاول به جمعیت معرفی شد.
در ابتدا از آن برای سفید کردن پنبه استفاده می شد، اما خیلی زود به یک ترکیب محبوب برای سفید کردن سایر مواد پوشاک تبدیل شد زیرا به سرعت مشخص شد که هیپوکلریت سدیم می تواند لکه های لباس را در دمای اتاق از بین ببرد. در فرانسه، هیپوکلریت سدیم هنوز به عنوان ژاول شناخته می شود.

آب ژاول چگونه ساخته می شود؟
روش تولید اصلی بارتولت (Barthollet’s) شامل عبور Cl۲ از طریق محلول کربنات سدیم بود، اما محلول حاصل از آن هیپوکلریت سدیم بسیار ضعیف بود. در حقیقت، افزودن گاز کلر به آب هم اسید هیدروکلریک و اسید هیپوکلرو می دهد:

افزودن نمک به این مخلوط امکان تشکیل محلول آبی هیپوکلریت سدیم را فراهم می آورد.
از تعادل، می بینید که افزودن اسید به این محلول، واکنش را به سمت چپ منتقل می کند و گاز کلر در آن تکامل می یابد. بنابراین، برای ایجاد سفید کننده های هیپوکلریت پایدار، تعادل باید به سمت راست رانده شود و این می تواند با اضافه کردن یک قلیایی مانند NaOH انجام شود.
یک روش تولید مؤثرتر در دهه ۱۸۹۰ توسط اسمیت (E.S Smith) اختراع شد. اسمیت که در آن از الکترولیز محلول نمک برای تولید NaOH و گاز Cl۲ استفاده شده است که سپس با هم مخلوط شدند تا NaOCl تشکیل شود. امروزه تنها روش بزرگ صنعتی برای تولید NaOCl فرایند هوکر (Hooker) نامیده می شود و فقط یک نسخه بهبود یافته از فرآیند الکترولیز اسمیت است.
در این حالت، گاز Cl۲ به محلول رقیق شده NaOH منتقل می شود و NaOCl را تشکیل می دهد و NaCl به عنوان محصول فرعی اصلی محسوب می شود. واکنش عدم تناسب (Cl۲ به طور همزمان اکسیده و کاهش می یابد) توسط الکترولیز به اتمام می رسد و مخلوط باید زیر ۴۰ درجه سانتیگراد نگه داشته شود تا از ایجاد ناخواسته کلرات سدیم جلوگیری شود.
عملکرد آب ژاول در صورت تماس با اسیدها
هیپوکلریت سدیم بسیار واکنش پذیر و در واقع ناپایدار است. در نتیجه در معرض اتمسفر، گاز کلر با سرعت قابل توجهی از محلول تبخیر می شود و در صورت گرم شدن، هیپوکلریت سدیم در نمک و اکسیژن جدا می شود. این اتفاق همچنین در صورت تماس با اسیدها، نور خورشید، فلزات خاص و بسیاری از گازها اتفاق می افتد و یکی از دلایلی است که می توان از سفید کننده در مقیاس وسیع استفاده کرد که پس از استفاده باعث تجزیه محصولات خوش خیم (نمک و آب) شده و بدون مشکل وارد سیستم زهکشی می شود.
سفید کننده با چندین روش عمل می کند. مؤلفه اسید هیپوکلرو (HOCl) یک ماده اکسید کننده بسیار قوی (حتی قوی تر از گاز کلر) است و می تواند با انواع مولکول ها از جمله رنگ ها با آن واکنش نشان داده و از بین ببرد. همچنین، یون هیپوکلریت به کلرید و یک شکل اکسیژن بسیار واکنش پذیر تجزیه میشود:

HOCl (به میزان کمتری Cl۲ و اکسیژن فعال) می تواند به پیوندهای شیمیایی موجود در یک ترکیب رنگی حمله کند یا کرومفور را به طور کامل از بین ببرد (بخشی از مولکول که رنگ آن را می بخشد) یا با تبدیل پیوندهای دوتایی در کروموفور را به یک پیوندهای منفرد، از این طریق مانع از جذب نور مرئی مولکول می شود.
هنگامی که با میکروب واکنش نشان داده شد، هیپوکلریت سدیم به پروتئین ها در سلول حمله می کند و باعث تجمع پروتئین ها می شود و میکروب ها به هم می پیوندند و می میرند. همچنین می تواند باعث ترکیدگی غشاهای سلولی شود. این حمله با طیف گسترده باعث می شود که سفید کننده در مقابل طیف وسیعی از باکتری ها مؤثر باشد.
هیپوکلریت سدیم قلیایی است و سفید کننده خانگی نیز حاوی NaOH است تا محلول قلیایی تر شود. هنگامی که هیپوکلریت سدیم در آب حل می شود، دو ماده تشکیل می شود. این ها اسید هیپوکلرو (HOCl) و یون هیپوکلریت (–OCl) هستند که نسبت این دو با pH آب تعیین می شود.
تولید سدیم هیپوکلریت توسط خنک کننده ها
هیپوکلریت سدیم با واکنش محلول رقیق سود سوز آور با کلر مایع یا گازی، همراه با خنک کننده تهیه می شود. هیپوکلریت سدیم معمولاً یا از طریق یک فرآیند ناپیوسته یا از طریق یک فرآیند مداوم و پیوسته تولید می شود. هیپوکلریت سدیم را می توان با استفاده از روش تولید ناپیوسته، مانند سیستم هیپوکلریت سدیم یا در حجم بیشتر با استفاده از روش پیوسته تولید کرد.
تولید پیوسته هیپوکلریت سدیم را می توان با سیستم بخار/ مایع خشک هیپوکلریت سدیم یا با سیستم هیپوکلریت سدیم پیوسته که از کلر بخار مرطوب از سلول های الکترولیتی استفاده می شود، بدست آورد.
۱- سیستم تولید هیپوکلریت سدیم به روش ناپیوسته (Batch) سیستم هیپوکلریت سدیم دسته ای مبتنی بر ۴۰ سال تجربه در کنار عملیات تولید سفید کننده است.
این سیستم برای تولید ۱۰۰۰ تا ۳۰۰۰ دسته گالن هیپوکلریت سدیم طراحی شده است. اصل اساسی کار این است که آب را درون مخزن GRP بازیافت قرار دهید و ۵۰٪ سود سوز آور اضافه کنید تا قدرت سود سوز آور تقریباً ۶.۷۵٪ (معمولا) باشد. در چند دسته، مقدار آب و مقدار سوز آور اضافه می شود و سپس خطوطی روی مخزن کشیده می شود تا به اپراتورها نشان داده شود که چه مقدار آب و سپس سوز آور اضافه می کنند.

۲- سیستم تولید هیپوکلریت سدیم به روش پیوسته (Continuous) سیستم تولید نمک کم قدرت و مقاومت بالا (High Strength Low Salt) می تواند تا ۳۰ درصد وزنی هیپوکلریت سدیم (سفید کننده) حاوی ۸.۵ درصد نمک تولید کند.
با کاهش مقدار نمک، سطح کلرات سدیم و کلرید سدیم حاصل از فن آوری، نمک پایین با مقاومت بالا (HSLS) محصولی با کیفیت و پایدار تولید می شود که ماندگاری قابل توجهی دارد و در مقایسه با هیپوکلریت سدیم استاندارد 4 درصد از نظر وزن سبکتر است (۱۳ درصد وزنی حاوی ۱۰.۴درصد وزنی نمک).
استحکام بالا و نمک پایین تولید هیپوکلریت یک فرآیند منحصر به فرد دو مرحله ای است که شامل مرحله کلرزنی و مرحله حذف نمک است. این کارخانه کاملاً اتوماتیک است و فقط در صورت بروز مشکل در فرآیند، نیاز به اپراتور دارد. این سیستم دارای میزان تولید قابل تنظیم بوده و قادر به تولید غلظت حداکثر ۳۸۵ گرم در هر لیتر کلر موجود است.
سیستم کاملاً به صورت کشویی روی قاب های فلزی سازه نصب شده اند. ابعاد سیستمی ۲۵ STPD که می تواند کلر را به ۳۰ درصد وزنی تبدیل کند، تقریباً ۴۰ در ۴۰ و ارتفاع ۲۰ فوت می باشد.

۳- سیستم تولید هیپوکلریت سدیم به روش بخار/ مایع خشک (Dry Liquid or Vapor) این سیستم در دو طرح موجود است: یکی که از کلر بخار خشک تحت فشار استفاده می کند یا یکی از کلر مایع خشک تحت فشار استفاده می کند. سیستم های استاندارد برای تولید غلظت های ۲۰-۲۰۰ گرم در لیتر کلر موجود با میزان تولید از ۲۵ تا ۱۵۰ گالن در دقیقه طراحی شده اند که معادل ۳۰-۲۰۰ STPD از کلر است.
این سیستم ها با نرخ های مختلف تولید در دسترس هستند. سیستم های استاندارد برای ۲۵، ۵۰، ۸۰ و ۱۵۰ گالن در دقیقه از ۱۶۰ گرم در هر لیتر کلر موجود رتبه بندی می شوند. هر سیستم نرخ تولید قابل تنظیم دارد و قادر به تولید ۲۰۰ گرم در هر لیتر کلر موجود است. با این حال، به دلیل افزایش بار گرما در سیستم، میزان تولید نامی تا ۱۶۰ گالن در دقیقه کاهش یابد.

۴- سیستم تولید هیپوکلریت سدیم به روش کلر بخار مرطوب از سلول های الکترولیتی فرایند هیپوکلریت سدیم یک فرآیند منحصر به فرد با استفاده از کلر بخار مرطوب و هیدروکسید سدیم (سوز آور) است. با حداقل هزینه عملیاتی، سفید کننده با کیفیت بالا تولید می کند.
این نیروگاه مجهز به دستگاه های ایمنی بی شماری است که در صورت خراب شدن فرآیند قصد خاموش کردن سیستم را دارند. این کارخانه کاملاً اتوماتیک است و فقط در صورت بروز مشکل در فرآیند، اپراتور نیاز دارد. این سیستم ها با نرخ های مختلف تولید در دسترس هستند.
سیستم های استاندارد برای ۵۰، ۱۰۰ و ۲۰۰ STPD از کلر رتبه بندی شده اند. هر سیستم دارای نرخ تولید قابل تنظیم است و قادر به تولید غلظت حداکثر ۲۰۰ گرم در هر لیتر کلر موجود است. مقاومت سفید کننده و سطح سوزش باقیمانده با تحمل بسیار بالا کنترل می شود و می تواند در هر زمان در طول تولید تنظیم شود.
سیستم ها برای عملیاتی کاملاً اتوماتیک طراحی شده اند و هر لحظه قابل شروع یا متوقف شدن هستند. سیستم ها روی قاب فولادی ساختاری تقریباً ۳۰ در ۱۲ و ارتفاع ۳۰ فوت نصب شده اند. این سیستم با سیستم اسکرابر کلر یکپارچه قابل طراحی است (همانطور که در تصویر مشاهده می شود). این باعث افزایش عرض سیستم به ۲۴ فوت می شود.

کاربرد آب ژاول در صنایع متفاوت
- کلر مایع خشک با حداقل فشار ۱۲۰ یا کلر بخار خشک با حداقل فشار ۱۵ PSIG.
- هیدروکسید سدیم با فشار ۴۵-۸۰ PSIG.
- آب (معمولاً آب نرم) را با فشار ۴۵-۸۰ PSIG.
- آب خنک کننده در دمای حداکثر ۸۵ درجه فارنهایت.
- هوای خشک با کیفیت ابزار با حداقل فشار ۸۰ PSIG.
- برق سه فاز برای موتورها.
- سیستم کنترل قدرت با کیفیت ابزار.
تجهیزات مورد استفاده فرآیند تولید هیپوکلریت سدیم
کلیه واحدها از بهترین مواد موجود برای به حداکثر رساندن عمر سرویس سیستم ساخته شده اند. مصالح استاندارد ساخت و ساز در زیر ذکر شده است. سایر مطالب در صورت درخواست موجود است.
- فرآوری آب، سوز آور و کلر: لوله ۸۰ استیل بدون درز با اتصالات فولادی ۳۰۰۰.
- آب خنک کننده: لوله ۸۰ و اتصالات PVC.
- هیپوکلریت سدیم: لوله و اتصالات استیل تفلون در مناطق تحت فشار و برنامه ریزی لوله ۸۰ و اتصالات PVC در مناطق کم فشار.
- پمپ هیپوکلریت سدیم: پمپ گریز از مرکز تیتانیوم با سیل مکانیکی منفرد.
- مخزن بازیافت هیپوکلریت سدیم: مخزن استیل با روکش لاستیکی کلروبوتیل سیاه.
- مبدل های حرارتی: صفحات و سبک قاب با صفحات تیتانیوم و واشر EPDM.
واکنش های جانبی خطرناک آب ژاول
اگر با رعایت مسائل ایمنی استفاده شود، سفید کننده بسیار بی خطر است. در سال ۲۰۰۲، انجمن سلطنتی بریتانیا برای پیشگیری از حوادث تخمین زد که حدود ۳۳۰۰ مورد وجود دارد که نیاز به معالجه بیمارستان ناشی از محلول های هیپوکلریت سدیم هر سال در خانه های انگلیس است.
بیشتر این ها به دلیل نوشیدن محلول به اشتباه بود (غالباً کودکانی که آن را از بطری بدون پلاک می نوشند)، اما بسیاری نیز به دلیل خطاهای دست زدن به آن ها صورت می گرفت. هیپوکلریت سدیم با بسیاری از معرف ها، حتی در برابر نور خورشید، برای تولید گاز کلر واکنش می دهد که در محیط های محصور می تواند یک محرک شدید ریه باشد.
از آنجا که سفید کننده خانگی حاوی NaOH (سود سوز آور) است، تماس با پوست باعث سوختگی در اثر از بین رفتن بافت چربی و روغن می شود. این فرآیند به عنوان صابون سازی شناخته می شود و روشی برای تولید صابون است. احساس لغزندگی سفیدکننده پوست روی ناخوشایند روغن های پوست و از بین رفتن بافت است!

مخلوط کردن سفید کننده با برخی مواد شیمیایی خانگی دیگر به دلیل واکنش های جانبی ناخواسته می تواند خطرناک باشد. همانطور که در بالا ذکر شد، افزودن اسید به سفید کننده، کلر گاز تولید می کند، در حالی که مخلوط کردن سفید کننده با محلول های آمونیاک (حتی ادرار) می تواند کلروآمین ها را تولید کند که سمی هستند:



فرآیند سفیدکننده سدیم
واکنش سفید کننده با برخی از محصولات خانگی مانند سورفکتانت ها و رایحه ها ترکیبات آلی کلرید شده و کلسترول VOC مانند تتراکلرید کربن (CCl۴) و کلروفرم (CHCl۳) را تولید می کند که می تواند برای سلامتی نیز مضر باشد. با این وجود، سود حاصل از تمیز کردن و ضد عفونی کردن مناطق خانگی احتمالاً از هرگونه اثرات مضر احتمالی این VOC بیشتر است. سفید کننده می تواند به شدت با پراکسید هیدروژن واکنش نشان دهد و گاز اکسیژن تولید کند.

مزایای هیپوکلریت سدیم غیرقابل اشتعال
- ضد باکتری، ضد قارچ، ضد ویروس
- واکنش سریع
- ارزان (به صورت رقیق شده)
- غیرقابل اشتعال
- بیوفیلم روی سطوح را کاهش می دهد
- نسبتا پایدار
- مورد استفاده در تصفیه آب
- مورد تایید سازمان حفاظت از محیط زیست
موارد استفاده از ضدعفونی کننده هیپوکلریت سدیم
- سفید کنندگی
- ضدعفونی کنندگی
- رنگ زدایی
- گند زدایی و بو زدایی
- بسته بندی حالت مایع، تانکر – بشکه ۲۲۰ لیتری
برای کسب اطلاعات بیشتر، مشاوره و خرید این محصول با متخصصان گروه فنی مهندسی اوژن (۰۲۶۳۲۷۰۸۹۹۵ – ۰۲۶۳۲۷۰۸۹۲۸) تماس بگیرید.
کلریناتور مایع در صنایع تصفیه کاغذسازی
پکیج های دوزینگ اکثرا ساده هستند، اما ممکن است مسائلی در مورد طراحی وجود داشته باشد. طراحی ممکن است در کنترل انتشار گاز از هیپوکلریت فله در دوز پمپ ها و لوله کشی و تشکیل مقیاس تأثیر بگذارد. گاز زدایی (بیشتر اکسیژن تولید می کند) می تواند منجر به تشکیل بخار یا حباب های گازی شود.
بخصوص اگر هیپوکلریت سدیم زیر فشار اتمسفر باشد، که منجر به قفل شدن گاز خط مکش در دیافراگم می شود. بنابراین پمپ ها باید از مکش آب گرفتگی محافظت شوند. مخازن باید به درستی از تمام ساختارها به جو خارج شوند.اغلب پکیج های دوزینگ در دسترس از پمپ های دیافراگمی استفاده می کنند.
نحوه عملکرد پمپ در کلریناتور مایع
عملکرد پمپ می تواند منجر به ایجاد خلاء شود. خلاء باعث تبخیر گازهای حل شده در هیپوکلریت سدیم می شود و در نتیجه پمپ از بین رفته و دوزینگ کلر اعمال شده کمتر می شود.در نتیجه، برای کمک به جلوگیری از گاززدایی، تنظیمات دوزینگ باید دارای سر مثبت روی مکش پمپ باشد (با ورودی پمپ همیشه زیر حداقل سطح مایع مخزن پلی پروپیلن).
علاوه بر این، باید از تنظیمات سیستم لوله کشی که سدیم NaOCl را بین دو دریچه جداسازی بسته یا شیرهای چک به دام میاندازد، خودداری شود. یک سیلندر کالیبراسیون، یک میراگر پالس، دریچه تسکین فشار و یک دریچه بارگیری اجزای اصلی یک پکیج دوزینگ کلر هستند.
سیستم های سوپاپ اتوماتیک شیرهای اتوماتیک نیز توسط برخی از تأمین کنندگان پمپ دوزینگ ارائه می شوند NaOCl یا از طریق یک نوار پخش کننده که درون یک کانال باز فرو رفته یا از طریق اتصالات تزریق (لوله کاروگیت تحت فشار)، تزریق می شود. دمپر نبض و پمپ دوزینگ باید نزدیک یکدیگر قرار بگیرند.
میرایی پالس همچنین به بهبود پراکندگی کمک می کند. توصیه می گردد سوپاپ بارگذاری نیز در سیستم هایی که فشار پشت در خط رانش پمپ کافی نیست <0.7-1.0) بار) فراهم گردد، تا اینکه یک شیر کنترل مکش در طرف مکش نصب شود.برای محافظت از دیافراگم در برابر پارگی ، یک PRV (شیر فشار) نیز باید در قسمت تزریق پمپ قرار گیرد.
عملکرد PRV باید ردیابی و هشدار داده شود: به عنوان مثال، دریچه خروجی می تواند به یک “دیگ گیر” کوچک، مجهز به سوئیچ شناور هدایت شود. تمام سیستم ها یا پمپ هایی که خاموش هستند باید حاوی روش هایی برای رفع فشار احتمالی باشند.از آنجا که هیدروکسید سدیم (NaOH) در ساخت محلول مورد استفاده قرار می گیرد،
pH محلول NaOCl زیاد است. در استفاده از آبهای سخت (یا آبهایی که CO2 موجود دارند) احتیاط بسیار لازم است، زیرا محصول بسیار قلیایی می تواند منجر به کاهش سرعت جریان، کاهش قطر لوله، کاهش ظرفیت پمپ و تشکیل کاویتاسیون در نقاط دوزینگ شود.
مزایای ضدعفونی کننده کلریناتور مایع
- می توان از هیپوکلریت سدیم نیز به عنوان ضد عفونی کننده استفاده کرد.
- هر دو هیپوکلریت سدیم و گاز کلر اثر ضد عفونی مشابه دارند.
- در مقایسه با گاز کلر، ضد عفونی کننده هیپوکلریت سدیم خطرات موجود در نگهداری و انتقال آن ها را کاهش می دهد.
- از مواد شیمیایی خطرناک در تولید سایت استفاده نمی شود. فقط از آب نرم شده و نمک درجه بالا (NaCl) استفاده می شود.
- در مقایسه با محلول تهیه شده استاندارد (غلظت ۱۴٪)، محلولهای هیپوکلرید سدیم (NaOCl) کم خطرتر (غلظت ۱٪) و در هنگام تولید محل تولید کمتر متمرکز هستند.
NaOCl می تواند به صورت تجاری در محل تأمین یا تولید شود، این روش، ایمن ترین روش موجود است. در تولید در محل، نمک با آب نرم شده حل می شود تا یک محلول آب نمک غلیظ تشکیل شود که متعاقباً رقیق شده و از مسیر یک سلول الکترولیتی عبور می کند تا هیپوکلریت سدیم تشکیل شود. هیدروژن نیز در حین الکترولیز تولید می شود و به دلیل خاصیت انفجاری آن باید از محلول تخلیه شود.
اقدامات مورد نیاز هنگام مواجه با کلریناتور
محلول NaOCl یک مایع خورنده با pH بالا است، یعنی ۱۲. بنابراین باید از اقدامات احتیاطی کلی در برخورد با مواد خورنده مانند جلوگیری از تماس فلز از جمله فولاد ضدزنگ استفاده شود. این محلول ها ممکن است حاوی کلرات باشد. با توجه به خورندگی محصول، کلرات را می توان در فرآیندهای تولید و ذخیره هیپوکلریت سدیم تشکیل داد.
تشکیل کلرات و خورندگی NaOCl به طور مستقیم با یکدیگر در ارتباط هستند. با کاهش خورندگی NaOCl می توان با جلوگیری از دمای زیاد ، کاهش قرار گرفتن در معرض نور و از طریق محدود کردن زمان ذخیرهسازی، تشکیل کلر را به حداقل رساند. مهار نشت برای مخازن ذخیرهسازی NaOCl باید فراهم شود. ساختارهای مهار نشت معمولی شامل زهکشی کف ، مهار کامل بزرگترین مخزن (همراه با تخته سنگ برای پاشش باران / آتشسوزی) و همچنین مهار جداگانه برای هر ماده شیمیایی ناسازگار است.
محلول NaOCl (یا سفید کننده مایع) یک محلول با غلظت ۵ تا ۱۵٪ کلر است. به عنوان ماده سفید کننده و تمیز کننده استفاده می شود. همچنین به عنوان ضد عفونی کننده آب بسیار مورد استفاده قرار می گیرد ، اما ممکن است مقرون به صرفه ترین راه حل نباشد زیرا گرانتر از گاز است. به جهت مایع بودن، به راحتی در مقایسه با کلر گازی، کلسیم هیپوکلریت قابل کنترل است،
اما به دلیل عدم ثبات و طبیعت خورنده باید نکات ایمنی هنگام استفاده رعایت گردد. به راحتی تولید می شود. تأمین مداوم نمک و برق برای تولید سفیدکننده مایع مورد نیاز است. به دلیل در دسترس بودن و قابلیت کنترل نسبی، سفید کننده مایع کاربرد POU بهتری دارد.
فرمالدئید صنایع تصفیه آب و فاضلاب (Formaldehyde)
ضدعفونی کننده فرمالدئید در هر دو حالت مایع و گازی به عنوان ضد عفونی کننده و استریلنت در صنایع مختلف مورد استفاده قرار می گیرد. فرمالدئید مایع به طور خلاصه در این مقاله مورد بررسی قرار می گیرد و فرم گازی در جای دیگر بررسی می شود. فرمالدئید بصورت عمده به عنوان محلول مبتنی بر آب به نام فرمالین فروخته می شود که از نظر وزن ۳۷٪ دارای فرمالدئید است.
این محلول آبی، کشنده باکتری، سل، قارچ کش، ویروس وکسید و اسپور کش است. OSHA اظهار داشته که محلول ضدعفونی کننده فرمالدئید باید در محیط کار به عنوان یک سرطان زا بالقوه اداره شود و استاندارد قرار گرفتن در معرض کارمندان برای فرمالدئید تعیین می کند که غلظت متوسط قرار گرفتن در معرض آن متوسط ۸ ساعته با غلظت ۰.۷۵ ppm را محدود می کند.

استاندارد شامل حد مجاز قرار گرفتن در معرض حالت دومی در قالب حد مجاز قرار گرفتن در معرض کوتاه مدت (STEL) 2 ppm است که حداکثر قرار گرفتن در معرض مجاز در طول یک دوره ۱۵ دقیقه است. مصرف فرمالدئید می تواند کشنده باشد، و قرار گرفتن طولانی مدت در معرض کم بودن سطح هوا یا پوست می تواند باعث مشکلات تنفسی مانند آسم و تحریکات پوستی مانند درماتیت و خارش شود.
به همین دلایل، کارکنان باید ارتباط مستقیم محدودی با فرمالدئید داشته باشند و این ملاحظات نقش آن را در فرآیندهای استریلنت و ضد عفونی محدود می کند. مقررات اصلی استاندارد OSHA که از کارگران در برابر قرار گرفتن در معرض فرمالدئید محافظت می کند، در عنوان ۲۹ قانون آیین نامه فدرال (CFR) قسمت ۱۹۱۰.۱۰۴۸ (مقررات معادل آن در ایالات با برنامه های دولتی تأیید شده با OSHA) آمده است.
نحوه عملکرد ضدعفونی کننده فرمالدئید
ضدعفونی کننده فرمالدئید، میکروارگانیسم ها را با آلکیل کردن گروه های آمینه و سولفیدرال پروتئین ها و اتم های نیتروژن حلقه پایه های پورین غیر فعال می کند.

مکانیزم میکروب زدایی فرمالدئید آبی
غلظت های مختلف محلول انواع ضدعفونی کننده فرمالدئید آبی طیف گسترده ای از میکروارگانیسم ها را از بین می برد. غیرفعال کردن پلی ویروس ها در ۱۰ دقیقه به ۸٪ غلظت فرمالین نیاز دارد ، اما همه ویروس های دیگر آزمایش شده با ۲٪ فرمالین غیرفعال شدند. چهار درصد فرمالدئید جهت سل کشنده است که ۱۰ به توان ۴ واحد سل را در ۲ دقیقه غیرفعال می کند و ۲.۵ درصد فرمالدئید حدود ۱۰ به توان ۷ سالمونلا تیف را در ۱۰ دقیقه با حضور ماده آلی غیرفعال می کند.
در آزمایشات مقایسه قدرت کشندگی فرمالدئید در مقابل اسپور مشاهده شد ۴ درصد فرمالدئید آبی برابر ۲٪ گلوتارآلدئید در برابر اسپورهای B.anthracis ضعیف تر از گلوتارآلدئید می باشد. برای رسیدن به عامل غیرفعال سازی ۱۰ به توان ۴ واحد از فاکتور آلودگی، محلول فرمالدئید ۲ ساعت تماس لازم داشت، در حالی که گلوتارآلدئید تنها ۱۵ دقیقه زمان نیاز داشت.

کاربردهای ضدعفونی کننده فرمالدئید در تصفیه بهداشتی
اگرچه فرمالدئید-الکل یک ماده ضدعفونی کننده شیمیایی است و فرمالدئید یک ماده ضد عفونی کننده سطح بالا است، اما استفاده های بهداشتی از فرمالدئید به دلیل دودهای تحریک کننده و بوی تند آن حتی در مقادیر بسیار کم (<ppm 1) محدود می شوند. به همین دلایل و موارد دیگر – از جمله نقش آن به عنوان یک سرطان زا مشکوک به انسان در ارتباط با سرطان بینی و سرطان ریه، این میکروب کش از جدول ۱ خارج شده است.
با این حال، قرار گرفتن در معرض بیش از حد فرمالدئید برای کارکنان واحد پیوند کلیه و دانشجویان در یک آزمایشگاه آناتومی ناخالص ثبت شده است. از فرمالدئید در مجموعه مراقبت های بهداشتی برای تهیه واکسن های ویروسی (به عنوان مثال آنفولانزا) استفاده می شود.

به عنوان یک عامل تقویت کننده و برای حفظ نمونه های آناتومیک و از لحاظ تاریخی برای استریل کردن ابزارهای جراحی بخصوص در مخلوط کردن اتانول استفاده شده است. یک بررسی در سال ۱۹۹۷ نشان داد که ۳۴٪ از مراکز همودیالیز در ایالات متحده از فرمالدئید برای پردازش دوباره همودیالیز استفاده می شود – ۶۰٪ کاهش از سال ۱۹۸۳ داشته است.
در صورت استفاده در دمای اتاق، غلظت ۴٪ با حداقل قرار گرفتن در معرض ۲۴ ساعت برای ضدعفونی کردن همودیالیزهای یکبار مصرف مجدداً در همان بیمار قابل استفاده است. محلول های آبی فرمالدئید (۱٪ -۲٪) نیز برای ضد عفونی کردن مسیرهای مایع داخلی دستگاههای دیالیز استفاده شده اند. برای به حداقل رساندن خطر احتمالی سلامتی برای بیماران دیالیز ، تجهیزات دیالیز باید کاملاً شستشو داده شده و قبل از استفاده برای فرمالدئید باقی مانده آزمایش شوند.
پارامترآلدئید، یک پلیمر جامد از فرمالدئید است، که می تواند با گرما بخار شود تا آلودگی گازها در کابینت های ایمنی بیولوژیکی جریان لمینار هنگام کار تعمیر و نگهداری یا تغییر فیلتر هنگام نیاز به دسترسی به قسمت بسته شده کابینت استفاده شود. جهت خرید این ماده ضد عفونی کننده و دیگر مواد شیمیایی می توانید با کارشناسان گروه اوژن در تماس باشید.
گاز کلر عاملی موثر در تصفیه اولیه و ثانویه آب و فاضلاب
کلر یک گاز سبز مایل به زرد است. با اعمال فشار زیاد، گاز مایع می شود، گاز کلر بسیار سمی است. گاز کلر بیشتر به عنوان ضد عفونی کننده آب مورد استفاده قرار می گیرد. افزودن کلر به آب نقش بسیار موثری در از بین بردن تقریباً همه میکروارگانیسم های بیماری زا دارد. می توان از آن به عنوان یک ماده ضد عفونی کننده اولیه و ثانویه استفاده کرد. این گاز برای استفاده در سیستم خانگی قابل استفاده نیست زیرا بسیار خطرناک می باشد. در غلظت های کم به میزان ۰.۱٪ هوا از نظر حجم کشنده است.
فواید گاز کلر در تصفیه آب
- کلرزنی منبع محدودتری نسبت به روشهای ضد عفونی اشعه ماوراء بنفش یا ازن است که برای تصفیه آب استفاده می شود.
- در برابر طیف گسترده ای از میکروارگانیسم های بیماری زا بسیار مؤثر است.
- میزان دوز به راحتی در محدوده دلخواه کنترل می شود.
- باقیمانده های کلر مانده در پساب فاضلاب می توانند حتی پس از تصفیه اولیه روند ضد عفونی را طولانی تر کنند.از اثرات آنها می توان برای ارزیابی اثربخشی بیشتر استفاده کرد.
واکنش گاز کلر در کارخانه ها و تصفیه فاضلاب صنعتی
اگرچه گاز کلر در کارخانه ها و شبکه های توزیع آب در مقیاس بزرگ به عنوان بهترین روش برای تصفیه آب مورد استفاده قرار می گیرد، اما هنوز محدودیت های مختلفی دارد. این محدودیت ها ممکن است کاربرد سیستم تصفیه استفاده تک منظوره (POU) را تحت تأثیر قرار دهد. مشکلات کلرزنی به دلیل نگرانی های زیبایی شناختی و بهداشتی است.
با توجه به ارزیابی های صورت گرفته ، بهتر است کلر زدایی انجام نشود زیرا باعث ایجاد طعم و مزه بد بو می شود. کشورهای توسعه یافته ممکن است به مردم خود در مورد تاثیرات خوب کلرزنی جهت ضدعفونی کردن آب آموزش های لازم را ارائه دهند. با این حال، کشورهای کمتر توسعه یافته فاقد این توانایی هستند.
محدودیت های استفاده از گاز کلر در مقیاس خانگی ممکن است شامل توزیع ، تهیه / تولید ، دوز کلر و استفاده دقیق از آن باشد. خطرات سلامتی ناشی از کلر تنها به ماهیت فرار آن محدود نمی شود. نگرانی ها عمدتا ممکن است به علت فرآورده های جانبی و ترکیبات ناقص اکسیده شده موجود در آب کلر باشد که باعث افزایش سمیت آن می شود.
معروف ترین فرآورده های کلرزنی، کلروارگانیک و تری هالومتان (THM) هستند. اسیدهای هومیک و فولویک به طور طبیعی در آب وجود دارند. هنگامی که کلر با این اسیدها واکنش نشان می دهد، تری هالومتان تشکیل می شود. در بسیاری از مطالعات مشخص شده است که برخی از این کلرو ارگانیک ها جهش یافته، سموم یا سرطان زا هستند. کلروفرم شناخته شده THM یک ماده سرطان زا برای حیوانات نیز است.
برخی دستورالعمل ها توسط USEPA (آژانس حفاظت از محیط زیست ایالات متحده) تنظیم شده است که THM ها نباید بیشتر از ۰.۱۰ میلی گرم در لیتر باشد. غلظت بالای THM به عوارض مضر جهت سلامتی منجر می شود.
فرآیند گاز کلر در اثر ترکیب با دیگر مؤلفه های شیمیایی
کلر به راحتی با کلیه مؤلفه های آب، یعنی مواد شیمیایی، موجودات کوچک، میکروارگانیسم ها، مواد گیاهی، بو، رنگ و غیره ترکیب می شود. مقدار کافی کلر برای تأمین نیاز کلر موجود در آب و تأمین ضد عفونی باقیمانده لازم است.
کلر باقیمانده (آزاد) به عنوان یکی از ترکیبات دیگر آبها ترکیب نمی شود. نقطه ای که کلر آزاد برای ضد عفونی مداوم در دسترس است به عنوان نقطه شکست نامیده می شود. سیستمی که در آن کلر آزاد با غلظت ۰.۳-۰.۵ میلی گرم در لیتر تهیه می شود یک سیستم ایده آل است.
کیت های آزمایش ساده، معمولاً کیت های تست رنگ سنجی DPD N) ، N-diethyl-p- (phenylenediamine برای تست نقطه شکست و مانده کلر در سیستم های تصفیه موجود است. کیت باید مقدار کلر آزاد را آزمایش کند ، نه کل کلر را.
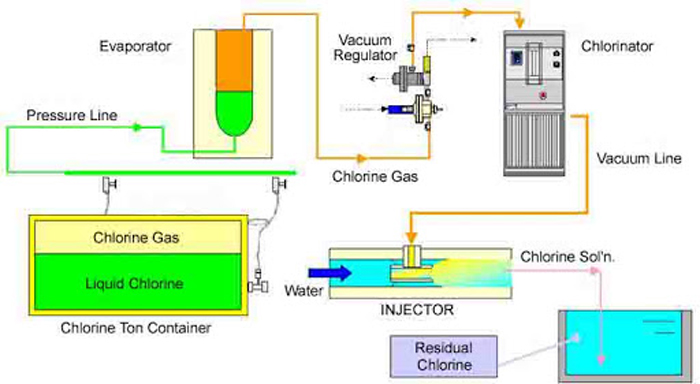
تجهیزات گاز کلر جهت کلرزنی
تجهیزات عمدتا شامل ۹۰۸ کیلوگرم (۲۰۰۰ پوند) یا ۶۸ کیلوگرم (۱۵۰ پوند) مخزن ، مقیاس توزین ، کلرور ، انژکتور ، ماژول های انتقال ، خطوط خلاء ، پمپ های تقویت کننده ، خطوط محلول ، دیفیوزرها و جریان سنج است. موارد ایمنی عبارتند از تهویه منفعل، تهویه مکانیکی، هشدار دهنده و دستگاه های هشدار دهنده، دوش، سخت افزار وحشت برای درها و شستشوی چشم. یک اتاق تنگ هوا برای تجهیزات کلرزنی مجزا است. این تجهیزات برای فرآیند ضد عفونی، ۱۰۰٪ گاز کلر موردنیاز است.
فرآیند گاز کلر در سیستم آب آشامیدنی
کلر را می توان به عنوان مایع یا گاز استفاده کرد. این ماده بسیار قوی و اکسید کننده است. هر دو شکل (مایع و گاز) از سیلندرهای گازی تحت فشار قابل ذخیره و استفاده هستند. سیلندرهای کلر می توانند ۱۵۰ پوند باشند. سیستم های آب آشامیدنی کوچک معمولاً از سیلندرهای ۱۵۰ پوندی استفاده می کنند.
یونهای هیپوکلروز و هیپوکلریت از ترکیب کلر با آب تشکیل می شوند. یون هیپوکلروز یک ماده ضد عفونی کننده بهتر است که در غلظت های بالاتر در غلظت pH پایین تشکیل می شود. یونهای هیپوکلریت و هیپوکلروز با غلظت مساوی در pH 7.3 وجود خواهند داشت.
در pH بالاتر از ۸.۳، یون هیپوکلریت غالب است که ضد عفونی کننده ای ضعیف تری است. بنابراین، ضد عفونی بهتر در pH کم حاصل می شود. برای جلوگیری از تشکیل تری هالومتان ها و اسیدهای هالواستاتیک ، باید همواره غلظت کلر باقی مانده اندازه گیری شود.
کلر دی اکسید (Chlorine dioxide) در صنعت تصفیه فاضلاب
کلر دی اکسید (Chlorine dioxide) که عمدتا به عنوان سفید کننده استفاده می شود، ماده ای موثر در فرآیند های گندزدایی و ضد عفونی است. این ماده ضد عفونی کننده به دلیل ویژگی های منحصر به فرد، حتی در غلظت های کم نیز موثر است. دی اکسید کلر در صنعت تصفیه فاضلاب و تصفیه آب به عنوان ضد عفونی کننده آب فاضلاب، تصفیه آب فرآیندهای صنعتی، ضد عفونی آب برج خنککننده و در تصفیه هوا صنعتی، تولید و تصفیه مواد غذایی، اکسیداسیون زباله های صنعتی و استریلیزاسیون گاز تجهیزات پزشکی استفاده می شود.

این گاز یک ترکیب کلر بی طرف است و با کلر اولیه بسیار متفاوت است، هم از نظر ساختار شیمیایی و هم در رفتار خود. کلرین دی اکساید یک مولکول کوچک، فرار و بسیار قوی است. در محلول های رقیق و آبکی، ClO2 یک رادیکال آزاد است. در غلظت های بالا با کاهش عوامل واکنش نشان می دهد. کلرید پراکساید یک گاز ناپایدار است که در گاز کلر، گاز اکسیژن و گرما جدا می شود.
هنگامی که دی اکسید کلر در اثر نور خورشید اکسیده می شود، از بین می رود. محصولات نهایی واکنش های ClO2 عبارتند از کلرید (Cl-)، کلریت (ClO-) و کلرات (ClO3-).

در دمای ۵۹- درجه سانتیگراد، ClO2 جامد به یک مایع قرمز مایل به قرمز تبدیل می شود. در دمای ۱۱ درجه سانتیگراد کلرین دی اکساید به گاز تبدیل می شود. دی اکسید کلر ۲،۴ برابر از هوا متراکم تر است. به عنوان یک کلرین دی اکساید مایع از چگالی بیشتر از آب برخوردار است.
کاربردهای دی اکسید کلر به عنوان اکسید کننده فعال
دی اکسید کلر می تواند به عنوان اکسید کننده یا ضد عفونی کننده استفاده شود. این یک اکسید کننده بسیار قوی است و به طور موثری میکروارگانیسم های بیماری زا مانند قارچ ها، باکتری ها و ویروس ها را از بین می برد. همچنین باعث جلوگیری و حذف فیلم زیستی می شود. به عنوان ضد عفونی کننده و سموم دفع آفات از آن به طور عمده به صورت مایع استفاده می شود. کلرید پراکساید همچنین می تواند در برابر آنتراکس استفاده شود، زیرا در برابر باکتری های تشکیل دهنده اسپور مؤثر است.

در صنعت الکترونیک برای تمیز کردن تابلوهای مدار، در صنعت نفت برای تصفیه سولفیدها و سفید کردن منسوجات و شمع ها استفاده می شود. در جنگ جهانی دوم، کلر کمیاب شد و از این ماده به عنوان سفید کننده استفاده شد. امروزه بیشتر از ClO2 برای سفید کردن کاغذ استفاده می شود. فیبر شفاف تر و قوی تری نسبت به کلر تولید می کند. این ماده این مزیت را دارد که باعث افزایش فرآورده های جانبی مضر نسبت به کلر می شود. از این گاز برای استریل تجهیزات پزشکی و آزمایشگاهی، سطوح، اتاق ها و ابزارها استفاده می شود.

ترکیب و مقایسه قدرت و ظرفیت کلرین دی اکساید
دی اکسید کلر انتخاب بسیار خوبی به عنوان یک اکسید کننده می باشد. این ماده این توانایی را به دلیل مکانیسم های تبادل یک الکترون منحصر به فرد دارد. این ترکیب شیمیایی به مراکز غنی از مولکول های آلی حمله می کند. یک الکترون منتقل شده و ClO2 به کلرید کاهش می یابد.
با مقایسه قدرت اکسیداسیون و ظرفیت اکسیداسیون مواد ضد عفونی کننده های مختلف، می توان نتیجه گرفت که ClO2 در غلظت های پایین موثر است. دی اکسید کلر به اندازه ازن یا کلر واکنش پذیر نیست و فقط با مواد سولفوریک، آمین ها و برخی دیگر از مواد آلی واکنش پذیر واکنش نشان می دهد. در مقایسه با کلر و ازن، برای به دست آوردن یک ماده ضدعفونی کننده باقیمانده فعال، ClO2 کمتر نیاز است. همچنین در صورت وجود مقدار زیادی ماده آلی می توان از آن استفاده کرد.
قدرت اکسیداسیون چگونگی واکنش یک اکسید کننده با ماده اکسید کننده را توضیح می دهد. ازن بالاترین استحکام اکسیداسیون را دارد و با هر ماده ای که اکسیده می شود، واکنش نشان می دهد. دی اکسید کلر ضعیف است، پتانسیل کمتری نسبت به اسید هیپوکلرو یا اسید هیپو برم دارد.

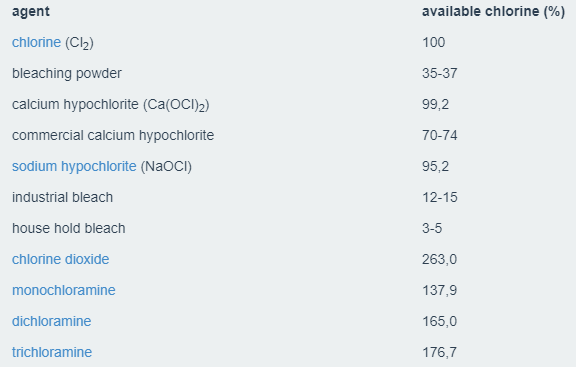
ظرفیت اکسیداسیون نشان می دهد که چگونه بسیاری از الکترون ها در یک واکنش اکسیداسیون یا کاهش انتقال می یابند. اتم کلر موجود در دی اکسید کلر دارای عدد اکسیداسیون ۴+ است. به همین دلیل، کلرید پراکساید (Chlorine dioxide) 5 الکترون را وقتی که به کلرید کاهش می یابد، می پذیرد. وقتی به وزن مولکولی نگاه می کنیم، کلرید دی اکسید حاوی ۲۶۳٪ “کلر موجود” است. این بیش از ۲،۵ برابر ظرفیت اکسیداسیون کلر است.
مقایسه های زیر نشان می دهد که هنگام واکنش کلرید پراستیک اسید چه اتفاقی می افتد. اول، کلرین دیاکساید یک الکترون را می گیرد و به کلریت کاهش می یابد:
ClO2 + e- ® ClO2-
یون کلریت اکسیده و تبدیل به یون کلرید می شود:
ClO2- + 4H + + 4e- ® Cl- + 2H2O
این مقایسه ها نشان می دهد که دی اکسید کلر به کلرید کاهش می یابد و در طی این واکنش ۵ الکترون را می پذیرد. تا زمان تشکیل کلرید پایدار، اتم کلر باقی می ماند. این توضیح می دهد که چرا هیچ ماده کلر تشکیل نمی شود. وقتی کلر واکنش نشان می دهد، فقط الکترون ها را نمی پذیرند. همچنین در واکنش های جایگزینی نیز شرکت می کند. در طی این واکنش ها، یک یا چند اتم کلر به ماده خارجی اضافه می شود.
آیا کلرین دی اکساید در آب قابل حل است؟
یکی از مهمترین خصوصیات دی اکسید کلر، محلول بودن آن در آب به ویژه در آب سرد است. این ماده هنگام ورود به آب هیدرولیز نمی شود. این یک گاز حل شده در محلول است. کلرید پراکساید تقریباً ۱۰ برابر بیشتر از کلر در آب محلول است و می توان آنرا با هوادهی یا دی اکسید کربن از بین برد.
چگونه می توان کلرید پراکساید را ذخیره کرد؟
بهترین راه برای ذخیره دی اکسید کلر به عنوان مایع در دمای ۴ درجه سانتیگراد است که در این حالت نسبتاً پایدار است. این محلول را نمی توان بصورت طولانی ذخیره نمود، زیرا به آرامی در کلر و اکسیژن جدا می شود. به ندرت به عنوان گاز ذخیره می شود، زیرا تحت فشار انفجاری است. هنگامی که غلظت بیش از ۱۰٪ دی اکسید کلر در هوا باشد، خطر انفجار وجود دارد.
در یک محلول آبی، کلرین دی اکساید پایدار و محلول است. محلول های آبی حاوی تقریباً ۱٪ دی اکسید کلر (۱۰ گرم در لیتر) با اطمینان از اینکه در اثر تداخل نور و گرما محافظت می شوند می توانند با خیال راحت ذخیره شوند. این ترکیب شیمایی به دلیل انفجار و بی ثباتی آن به ندرت حمل می شود. معمولاً در سایت تولید می شود.

کاشف کلرید پراکساید
دی اکسید کلر در سال ۱۸۱۴ توسط سر همفری دیوی کشف شد. او این گاز را با ریختن اسید سولفوریک (H2SO4) روی کلرات پتاسیم (KClO3) تولید کرد. اسید سولفوریک جایگزین اسید هیپوکلروید (HOCl) شد. در چند سال گذشته از این واکنش برای تولید مقادیر زیادی ClO۲ نیز استفاده شده است. به جای کلرات پتاسیم از کلرات سدیم (NaClO3) استفاده شد.
۲NaClO3 + 4HCl ==> 2ClO2 + Cl2 + 2NaCl + 2H2O
دی اکسید کلر چگونه تولید می شود؟
دی اکسید کلر تحت فشار انفجاری و حمل و نقل آن دشوار است و معمولاً به عنوان محلول آبی یا گاز تولید می شود. این ماده در محلول های اسیدی کلرید سدیم (NaClO2) یا کلرات سدیم (NaClO3) تولید می شود. برای تأسیسات کلرید سدیم، گاز کلر، کلرید هیدروژن سدیم (NaHClO2) و اسید سولفوریک یا هیدروژن برای تولید ClO۲ در محل استفاده می شود.
برای تولید گاز کلرین دی اکساید، اسید هیدروکلریک (HCl) یا کلر با کلرید سدیم همراه است.
واکنش های اصلی عبارتند از:
۲NaClO2 + Cl2 ==> 2ClO2 + 2NaCl
(هیپوکلریت اسیدی شده همچنین می تواند به عنوان منبع جایگزین کلر مورد استفاده قرار گیرد.)
۵NaClO2 + 4HCl ==> 4 ClO2 + 5NaCl + 2H2O
(یکی از مضرات خطرناک بودن آن است.)
یک گزینه دیگر:
۲NaClO2 + Na2S2O8 ==> 2ClO2 + 2Na2SO4
دی اکسید کلر همچنین با واکنش هیپوکلریت سدیم با اسید هیدروکلریک می تواند تولید شود:
HCl + NaOCl + 2NaClO۲ ==> 2ClO۲ + ۲NaCl + NaOH
مقدار دی اکسید کلر تولید شده بین ۰ تا ۵۰ گرم در لیتر متغیر است.
الکل، باکتری و ویروس کش شیمیایی
در زمینه مراقبت های بهداشتی ، واژه “الکل” به دو ترکیب شیمیایی محلول در آب یعنی اتیل الکل و ایزوپروپیل الکل اشاره دارد که عموماً از ویژگی های میکروب کش کمی برخوردار هستند. سازمان FDA هیچ ماده ضد عفونی کننده شیمیایی مایع یا سطح بالای آن را با الکل به عنوان ماده اصلی فعال مشخص نکرده است.
این الکل ها به سرعت باکتری کشند و نه عقیم کننده در برابر اشکال رویشی باکتری ها. آنها همچنین سل، قارچ کش و ویروس کش هستند اما اسپورهای باکتریایی را از بین نمی برند .میزان سمیت آنها هنگام رقیق کردن در غلظت زیر ۵۰٪ به شدت کاهش می یابد و غلظت بهینه باکتری کشی محلول ۶۰٪ -۹۰٪ در آب است. (حجم / حجم). در این مقاله مکانیزم ضدعفونی باالکل و کاربرد های آن تشریح می شود.
نحوه ضدعفونی و دفع پروتئین توسط الکل
عملی ترین توضیح برای اثر میکروب زدایی ماده ضدعفونی کننده الکل، دفع پروتئین است. این مکانیسم با مشاهده این نکته تأیید می شود که الکل اتیل صد در صد، ترکیب بدون آب، نسبت به مخلوط های الکل و آب قدرت کشندگی باکتری کمتری دارد زیرا پروتئین ها در حضور آب سریعتر از بین می روند.
در رابطه با دناتوراسیون پروتئین مشاهدات نشان داده است که الکل باعث کاهش هیدروژنازهای باکتری اشریشیا کولی می شود و اینکه اتیل الکل فاز رشد تاخیری آئروژن های انتروباکتر را افزایش می دهد و با افزودن اسیدهای آمینه خاص می توان اثر فاز رشد تاخیری را معکوس کرد. باورها بر این است که عملکرد عقیم سازی باکتری ها با مهار تولید متابولیت های لازم از تقسیم سریع سلول ها چلوگیری می کند.

فعالیت های میکروبی ضدعفونی
الکل متیل (متانول) ضعیف ترین عمل ضد باکتریایی الکل ها را دارد و بنابراین به ندرت در مراقبت های بهداشتی مورد استفاده قرار می گیرد. فعالیت ضد باکتریایی غلظت های مختلف الکل اتیل (اتانول) در برابر انواع میکروارگانیسم ها در دوره های مواجهه از ۱۰ ثانیه تا ۱ ساعت مورد بررسی قرار گرفته است.
سودوموناس آئروژینوزا در ۱۰ ثانیه با غلظت اتانول از ۳۰٪ تا ۱۰۰٪ (حجم/حجم) کشته شد و سراتیا مارشیسنز، اشرشیا کولی و سالمونلا در ۱۰ ثانیه با غلظت اتانول از ۴۰٪ تا ۱۰۰٪ کشته شدند. ارگانیسم های گرم مثبت استافیلوکوکوس اورئوس و استرپتوکوک پیوژنز کمی مقاوم تر بودند و در ۱۰ ثانیه با غلظت اتیل الکل ۶۰٪ -۹۵٪ کشته شدند. الکل ایزوپروپیل (ایزوپروپانول) کمی باکتری کشنده تر از اتیل الکل برای E. coli و S. aureus می باشد.
الکل اتیل ، با غلظت ۸۰-۶۰٪ ، یک عامل ویروس کش قوی است که همه ویروس های لیپوفیلیک (مانند تبخال ، واکسیناسیون و ویروس آنفلوانزا) و بسیاری از ویروس های آبگریز (مانند آدنو ویروس، انتروویروس، رینو ویروس و روتا به جز ویروس هپاتیت A (HAV) یا پولیو ویروس) را غیرفعال می کند.
ایزوپروپیل الکل در برابر اینترو ویروس های غیر لیپیدی فعال نیست اما کاملاً در برابر ویروس های لیپیدی فعال است. مطالعات همچنین توانایی اتیل و ایزوپروپیل الکل را برای غیرفعال کردن ویروس هپاتیت B (HBV) و ویروس تبخال و اتیل الکل در غیرفعال کردن ویروس ایدز (HIV)، روتاویروس، اکوویروس و آستروویروس نشان داده است.
در آزمایشات اثر اتیل الکل در برابر سل، ۹۵٪ اتانول مولدهای سل در تعلیق یا مخلوط آب طی ۱۵ ثانیه توسط ماده ضدعفونی کننده الکل کشته شد. در سال ۱۹۶۴، اسپاولدینگ اظهار داشت که الکل ها میکروب کش انتخابی برای فعالیت های سل هستند و باید استانداردی باشند که با آن همه انواع سل های دیگر مقایسه می شوند.
به عنوان مثال، وی فعالیت سل را از یدوفور (۴۵۰ ppm)، یک ترکیب فنل جایگزین (۳٪) و ایزوپروپانول (۷۰٪ در حجم) با استفاده از تست لوپ حلقوی (۱۰ به توان ۶ ویروس سل در هر لوپ) مقایسه کرد و زمان تماس را که برای نابودی کامل به ترتیب ۱۲۰-۱۸۰ دقیقه، ۴۵-۶۰ دقیقه و ۵ دقیقه نیاز بود تعیین کرد.
تست لوپ حلقوی یک آزمایش پیشرفته است که برای تعیین طولانی ترین زمان برای زنده ماندن میکروب ها تولید شده است. بنابراین، این ارقام نباید در زمان مورد نیاز قرار گرفتن در معرض بیماری هنگام استفاده از این میکروب ها بر روی مواد پزشکی یا جراحی، استنباط شوند.
الکل اتیل (۷۰٪) مؤثرترین غلظت برای از بین بردن فاز بافت Cryptococcus neoformans ،Blastomyces dermatitidis ،Coccidioides immitis و Histoplasma capsulatum و مراحل کشت سه ارگانیسم انترولیزه شده بر روی سطوح مختلف می باشد. مرحله کشت نسبت به عمل اتیل الکل مقاوم تر بود و حدود ۲۰ دقیقه برای ضد عفونی کردن سطح آلوده نیاز داشت ، در حالی که مرحله بافت <1 دقیقه جهت ضدعفونی شدن زمان نیاز داشت.
ایزوپروپیل الکل (۲۰٪) در کشتن کیست های Acanthamoeba culbertsoni (560) مانند کلرهگزیدین، پراکسید هیدروژن و تیمروز موثر است.

کاربردهای ضدعفونی کننده الکل فاقد عملکرد اسپورکش
ضدعفونی کننده الکل برای استریل کردن مواد پزشکی و جراحی به طور عمده توصیه نمی شوند زیرا فاقد عملکرد اسپور کش هستند و نمی توانند در مواد غنی از پروتئین نفوذ کنند.عفونت های کشنده زخم بعد از عمل با کلستریدیوم زمانی اتفاق افتاده است که از ضدعفونی کننده الکل ها برای استریل کردن ابزارهای جراحی آلوده به اسپورهای باکتریایی استفاده شده است.
از الکل ها به طور موثری برای ضدعفونی کردن دماسنج های دهانی و روده ای، پیجر بیمارستانی، قیچی و استتوسکوپ و آندوسکوپ های فیبروپتیک استفاده شده است، اما عدم موفقیت این ضد عفونی کننده منجر به عفونت شده است. حوله های الکلی سال هاست که برای ضدعفونی کردن سطوح کوچک مانند درپوش های لاستیکی ویال های دارویی با انواع دوزها و یا بطری های واکسن استفاده می شوند.
علاوه بر این، گاهی اوقات از الکل برای ضد عفونی سطوح خارجی تجهیزات (به عنوان مثال، ستتوسکوپ ها، دستگاه های تهویه مطبوع، کیسه های تهویه دستی)، مانکن های CPR ، ابزار سونوگرافی یا مناطق آمادهسازی دارو استفاده می شود. دو مطالعه اثربخشی ۷۰٪ الکل ایزوپروپیل در ضدعفونی کردن مبدل قابل استفاده مجدد در یک محیط کنترل شده را نشان داده اند. در مقابل، سه شیوع عفونت جریان خون زمانی که الکل برای ضد عفونی کننده هد مبدل در یک مرکز مراقبت های ویژه مورد استفاده قرار گرفت، مشاهده گردید.
کمبود اطلاعات در مورد تاثیر ضدعفونی کننده الکل در تجهیزات این است که آنها به اتصالات پوسته سازه ای لنز آسیب می رسانند، تمایل به تورم و سفت شدن لاستیک و برخی از لوله های پلاستیکی پس از استفاده طولانی مدت و مکرر، کاشی های پلاستیکی و پلاستیکی سفید کننده و آسیب به نکات تن سنج (با خراب شدن چسب) بعد از معادل ۱ سال کارکرد معمول. قطعات دستگاه تنونومتر که به مدت ۴ روز در الکل خیس شده و سطوح ضبر ایجاد شده است که به طور بالقوه می تواند باعث آسیب قرنیه شود.
به نظر می رسد که این امر با ضعف مواد سیمانی مورد استفاده در ساخت دوقلوها ایجاد شده است. هنگامی که نکات تنومتر بلافاصله قبل از اندازه گیری فشار داخل چشمی با الکل جابجا شدند، کدورت قرنیه گزارش شده است. الکل ها قابل اشتعال هستند و به همین دلیل باید در یک منطقه خنک و با تهویه مناسب نگهداری شوند. آنها همچنین به سرعت تبخیر می شوند، به همین جهت مدت زمان طولانی در معرض قرار گرفتن را دشوار می کند مگر اینکه موارد غوطه ور شوند.
ارتو فتالدهید ضدعفونی کننده سطح بالا حاوی (OPA)
ارتو فتالدهید Ortho-fhthalaldehyde یک ماده ضد عفونی کننده سطح بالا است که در اکتبر ۱۹۹۹ مجوز کالا از FDA را دریافت کرده است. این ماده حاوی (۰.۵۵٪ ۱،۲-benzenedicarboxaldehyde (OPA بنزن کربوکسی الدهید است. محلول OPA یک مایع شفاف و کم رنگ و با pH برابر ۷.۵ است.
نحوه عملکرد ارتو فتالدهید و گلوتارآلدئید با اسیدهای آمینه
مطالعات اولیه در مورد نحوه عملکرد OPA نشان می دهد که هر دو OPA و گلوتارآلدئید با اسیدهای آمینه، پروتئین ها و میکروارگانیسم ها در تعامل هستند. با این حال، OPA یک عامل اتصال متقاطع با قدرت کمتر است. علت آن طبیعت معطر لیپوفیلی OPA است که احتمالاً به جذب آن از طریق لایه های بیرونی مایکوباکتری ها و باکتری های گرم منفی کمک می کند. به نظر می رسد OPA با مسدود کردن روند جوانه زنی اسپور ، اسپورها را از بین می برد.
فعالیت های میکروبی OPA در شرایط ویتو
مطالعات فعالیت میکروبی کشنده عالی در شرایط ویتو را نشان داده اند. به عنوان مثال، OPA فعالیت مایکوباکتریایی عالی (کاهش ۵-log10 در ۵ دقیقه) نسبت به گلوتارآلدئید دارد. میانگین زمان مورد نیاز برای تولید ۶-log10 کاهشی برای M. bovis با استفاده از ۰.۲۱٪ OPA ، ۶ دقیقه بود، در مقایسه با استفاده از گلوتارآلدئید ۱.۵٪، ۳۲دقیقه می باشد.
استفاده ازOPA نتایج خوبی در برابر مایکوباکتری های مورد آزمایش ، از جمله استرین های مقاوم به گلوتارآلدئید نشان داد ، اما ۵/۰٪ OPA با ۲۷۰ دقیقه قرار گرفتن در معرض، قادر به اسپورکشی نبود. افزایشpH از سطح غیر قابل تنظیم آن (در حدود ۶.۵) تا pH 8 باعث افزایش فعالیت اسپور کشی OPA شد.
سطح فعالیت میکروبکشی مستقیماً با دما مرتبط بود. کاهش بیشتر از ۵ -log10 واحد اسپور آتروفوز در ۳ ساعت در ۳۵ درجه سانتیگراد ، تا ۲۴ ساعت در ۲۰ درجه سانتی گراد مشاهده شد. همچنین ، با مدت زمان قرار گرفتن در معرض ۵ دقیقه ، فعالیت میکروبکشی با افزایش غلظت محلول کاهش یافته است. با این حال ، هنگامی که زمان قرار گرفتن در معرض ۱۰ دقیقه بود ، کارآیی متفاوت نخواهد بود. علاوه بر این ، OPA در برابر طیف گسترده ای از میکروارگانیسم ها ، از جمله مایکوباکتری های مقاوم به گلوتارآلدئید و اسپورهای آتروفوز مؤثر است.
تاثیر سازگاری آزمایشگاهی استرین ها، مانند باکتری های آروگینوزا ، تا ۰.۵۵٪ OPA ارزیابی شده است. استرین های مقاوم و چند مقاومتی پس از سازگاری آزمایشگاهی در شرایط حساسیت به OPA به طور معنی داری افزایش یافت (به ترتیب عوامل کاهش log10 برای استرین های مقاوم و چند مقاومت به میزان ۰.۵۴ و ۰.۹۱ افزایش یافت). مطالعات دیگر نشان داده است که سلول های طبیعی آروگینوسا نسبت به سلول های کشت شده در آزمایشگاه درمقابل انواع ضد عفونی کننده مقاوم تر هستند.
کاربردهای ارتو فتالدهید نسبت به گلوتارآلدئید
ارتو فتالدهید نسبت به گلوتارآلدئید چندین مزیت بالقوه دارد. پایداری عالی در طیف وسیعی از pH (pH 3–۹) دارد ، یک ماده تحریک کننده شناخته شده برای چشم ها و معابر بینی نیست ، نیازی به نظارت بر قرار گرفتن ندارد ، شدت بو به سختی قابل درک است و نیازی به فعال سازی ندارد. OPA مانند گلوتارآلدئید دارای سازگاری عالی مواد است.
یک نقطه ضعف احتمالی OPA این است که پروتئین های خاکستری را لکه دار می کند (از جمله پوست محافظت نشده) و بنابراین باید با احتیاط رفتار کرد. با این وجود ، رنگ آمیزی پوست نشانگر رسیدگی نادرست است که به آموزش اضافی و / یا تجهیزات محافظ شخصی (به عنوان مثال، دستکش، محافظت از چشم و دهان و لباس های مقاوم در برابر مایعات) نیاز دارد.
نتایج یک مطالعه مبنای توصیه ای را مبنی بر اینکه شستشو وسایل ضد عفونی شده با OPA به حداقل ۲۵۰ میلی لیتر آب در هر دوره نیاز دارد تا باقیمانده شیمیایی را به حدی برساند که امنیت بیمار یا کارکنان را به خطر نیاندازد. وسایل محافظ شخصی باید هنگام کار با ابزارهای آلوده ، تجهیزات و مواد شیمیایی پوشیده شوند. علاوه بر این ، تجهیزات باید کاملاً شستشو شوند تا از تغییر رنگ پوست یا غشای مخاطی بیمار جلوگیری شود.
در آوریل ۲۰۰۴، سازنده OPA اطلاعاتی را در مورد بیمارانی که یک واکنش مشابه آنافیلاکسی پس از سیستوسکوپی که در آن دامنه با استفاده از OPA دوباره پردازش شده بود ، به کاربران منتشر کرد. از حدود ۱ میلیون روش اورولوژی که با استفاده از ابزارهای پردازش مجدد با استفاده از OPA انجام شده است،
۲۴ مورد (۱۷ مورد در ایالات متحده، شش مورد در ژاپن، یک مورد در انگلستان) از واکنش های آنافیلاکسی مانند پس از سیستوسکوپی مکرر (به طور معمول پس از چهار تا نه) گزارش شده است. درمان) اقدامات پیشگیرانه شامل از بین بردن بقایای OPA با شستشوی کامل و عدم استفاده از OPA برای پردازش مجدد ابزار اورولوژیک مورد استفاده در معالجه بیماران با سابقه سرطان مثانه است (نوین اریان، ارتباطات شخصی، ۴ ژوئن ۲۰۰۴ ؛ اطلاع رسانی درباره محصول، محصولات ضدعفونی شده پیشرفته، ۲۳ آوریل، ۲۰۰۴)
مطالعات بالینی OPA در معرض باکتری ها
چند مطالعه بالینی OPA در دسترس است. در یک مطالعه کاربردی بالینی، قرار گرفتن در معرض OPA از ۱۰۰ آندوسکوپ به مدت ۵ دقیقه منجر به کاهش> 5-log10 در بار باکتری ها شد. علاوه بر این ، OPA بیش از یک چرخه استفاده ۱۴ روزه مؤثر بود. داده های تولید کننده نشان می دهد که OPA قبل از رسیدن به حد MEC خود (MEC پس از ۸۲ چرخه) نسبت به گلوتارآلدئید (MEC بعد از ۴۰ چرخه) در پردازشگر آندوسکوپ اتوماتیک دوام بیشتری خواهد داشت.
کروماتوگرافی مایع با فشار بالا تأیید کرد که سطح OPA حداقل در ۵۰ سیکل بالای ۰.۳٪ حفظ می شود. OPA باید مطابق مقررات محلی و ایالتی دور شود. اگر دفع OPA از طریق سیستم فاضلاب بهداشتی محدود باشد، می توان از گلیسین (۲۵ گرم در گالن) برای خنثی کردن OPA استفاده کرد و آن را برای دفع ایمن کرد.
ادعاهای برچسب ضد عفونی کننده سطح بالا برای محلول OPA در دمای ۲۰ درجه سانتیگراد در سراسر جهان متفاوت است (برای مثال ، ۵ دقیقه در اروپا ، آسیا و آمریکای لاتین ؛ ۱۰ دقیقه در کانادا و استرالیا و ۱۲ دقیقه در ایالات متحده). این ادعاهای برچسب به دلیل تفاوت در روش آزمایش و الزامات مربوط به مجوز در سراسر جهان متفاوت است. در یک پردازنده آندوسکوپی خودکار با قابلیت تایید FDA برای حفظ دمای محلول در ۲۵ درجه سانتیگراد ، زمان تماس برای OPA 5 دقیقه است.
پراکسی اسید با عملکرد سریع در برابر انواع میکروارگانیسمها
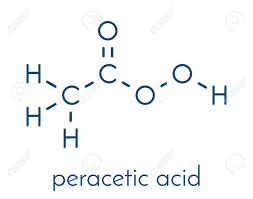
اسید پراستیک ، پرسیدین یا پراکسی استیک با عمل سریع در برابر همه میکروارگانیسم ها شناخته می شود. مزایای ویژه پراستیک اسید این است که فاقد محصولات تجزیه مضر می باشد(به عنوان مثال ، اسید استیک، آب، اکسیژن، پراکسید هیدروژن) ، باعث حذف مواد آلی می شود و هیچ باقیمانده ای باقی نمی گذارد.
این ماده در حضور ماده آلی مؤثر است و حتی در دماهای پایین نیز اسپور کش است. اسید پراستیک دربرابر مس ، برنج ، برنز ، فولاد ساده و آهن گالوانیزه خورنده است اما با افزودنی ها و اصلاح pH این اثرات کاهش می یابد. این محلول به ویژه هنگام رقیق بودن ناپایدار است. به عنوان مثال ، یک محلول ۱٪ در ۶ روز نیمی از قدرت خود را از طریق هیدرولیز از دست می دهد ، در حالی که ۴۰٪ اسید پراستیک ۱٪ -۲٪ از ترکیبات فعال خود را در هر ماه از دست می دهد.
مکانیسم اسید پراکسید در مقایسه با سایر اکسیدکننده ها
در مورد مکانیسم عملکرد اسید پراستیک چیز کمی شناخته شده است، اما اعتقاد بر این است که عملکرد آن مشابه سایر اکسید کننده هاست – یعنی پروتئین ها را ازبین می برد، نفوذپذیری دیواره سلولی را مختل می کند و پیوندهای سولفیدریل و گوگرد را در پروتئین ها، آنزیم ها، متابولیت ها و غیره را اکسیده می کند.
فعالیت های باکتری کش پراکسید
اسید پراستیک باکتری های گرم مثبت و گرم منفی، قارچ ها و مخمرها را در مدت زمان کمتر از ۵ دقیقه در ۱۰۰ppm غیرفعال می کند. در حضور ماده آلی، ۲۰۰-۵۰۰ ppm مورد نیاز است. برای ویروس ها، دامنه دوز وسیع است (۱۲-۲۲۵۰ ppm)، ولی با ضد ویروس در ۱۵ دقیقه با ۱.۵۰۰-۲۵۰ ppm غیرفعال می شود.
در یک مطالعه، ۵/۳ درصد اسید پراستیک پس از قرار گرفتن در معرض ۱ دقیقه با استفاده از تست حامل در برابر HAV بی اثر بود. اسید پراستیک (%۰.۲۶) در برابر همه گونه های تست مایکوباکتری ها (M. tuberculosis ، M. avium-intracellulare M. chelonae و M. fortuitum) در مدت زمان ۲۰ تا ۳۰ دقیقه در حضور یا عدم وجود بار آلی اثر گذار بود (فاکتور کاهش log10> 5).
با اسپورهای باکتریایی، ۵۰۰-۱۰،۰۰۰ پی پی ام (۰.۰۵٪ -۱٪) با استفاده از تست تعلیق اسپور، اسپورها را در ۱۵ ثانیه تا ۳۰ دقیقه غیرفعال می کنند.
کاربرد پراکسید در عقیم سازی مؤلفه های شیمیایی
یک دستگاه خودکار با استفاده از این میکروب زدا برای عقیم سازی شیمیایی پزشکی (به عنوان مثال، آندوسکوپ، آرتروسکوپ)، جراحی و دندان در آمریکا استفاده می شود. همانطور که قبلاً نیز اشاره شد، دستگیره های دندانپزشکی باید با بخار استریل شوند.
استریلانت، ۳۵٪ اسید پراستیک، با آب تصفیه شده با دمای ۵۰ درجه سانتیگراد به ۰.۲٪ رقیق می شود. کارآزمایی های شبیه سازی شده، فعالیت میکروبی کشی بسیار خوبی را نشان داده اند و سه کارآزمایی بالینی هم قدرت میکروب کشی عالی را نشان داده اند و همچنین هیچگونه عارضه بالینی منجر به عفونت را نشان نداده اند.
کارایی بالای سیستم در مقایسه اثر بخشی سیستم با کارایی اکسید اتیلن نشان داده شده است. فقط سیستم اسید پراستیک ۶ log10 از گونه M.chelonae ،E. faecalis و B.atrophaeus اسپور را با چالش آلی و معدنی به طور کامل کشته است.
یک تحقیق که در مقایسه هزینه ها، عملکرد و نگهداری تجهیزات آندوسکوپی ارولوژیکی پردازش شده توسط ضد عفونی سطح بالا (با گلوتارآلدئید) با آنهایی که از سیستم اسید پراستتیک وجود دارد هیچ اختلاف بالینی بین این دو سیستم گزارش نکرد.
استفاده از این سیستم منجر به هزینه های بالاتر از ضد عفونی سطح بالا، از جمله هزینه های پردازش (۶.۱۱ دلار در مقابل ۰.۴۵ دلار در هر چرخه)، خرید و آموزش (۲۴۸۴۵ دلار در مقابل ۱۶ دلار)، نصب (۵،۸۰۰ دلار در مقابل ۰ دلار) و تعمیرات آندوسکوپ (۶،۰۳۷ دلار در مقابل ۴۴۵ دلار).
یک ماده ضد عفونی کننده سطح بالا مطابق استاندارد در انگلستان حاوی ۰.۳۵٪ اسید پراستیک است. اگرچه این محصول در برابر طیف گسترده ای از میکروارگانیسم ها به سرعت مؤثر است، اما فلز آندوسکوپ ها را لکه دار می کند و ناپایدار است، در نتیجه تنها عمر ۲۴ ساعته دارد.
فنولیک میکروب کش تجهیزات جراحی
فنل از زمان استفاده اولیه به عنوان میکروب کش توسط لیستر در کارهای پیشگامانه خود در زمینه ضد عفونی کننده تجهیزات جراحی، جایگاه برجسته ای را در زمینه ضد عفونی کننده بیمارستان به خود اختصاص داده است. با این حال در ۳۰ سال گذشته، کار بر روی مشتقات بیشمار فنل یا فنلی و خواص ضد میکروبی آنها متمرکز شده است.
مشتقات فنل وقتی منشأ می گیرند که یک گروه کاربردی (به عنوان مثال، آلکیل، فنیل، بنزیل، هالوژن) یکی از اتم های هیدروژن را در حلقه آروماتیک جایگزین کند. دو مشتقات فنل که معمولاً به عنوان ترکیبات ضد عفونی کننده های بیمارستانی یافت می شوند، ارتو فنیل فنول و ارتو بنزیل-پار کلرو فنول هستند.
خواص ضد میکروبی این ترکیبات و بسیاری از مشتقات دیگر فنل نسبت به مواد شیمیایی اولیه بسیار بهبود یافته است. فنل ها توسط مواد متخلخل جذب می شوند و مواد ضدعفونی کننده باقیمانده می توانند بافت را تحریک کنند. در سال ۱۹۷۰، تخریب پوست ناشی از مواد شوینده میکروب کش فنولیک حاوی بوتیل فنول سوم فرعی و آمیل فنول سوم فرعی گزارش شده است.
عملکرد فنولیک به عنوان سم پروتوپلاسمی
در غلظت های بالا، فنل به عنوان یک سم پروتوپلاسمی ناخالص عمل می کند، باعث نفوذ و مختل دیواره سلولی و رسوب پروتئین های سلولی می شود. غلظت کم فنل و مشتقات فنول با وزن مولکولی بالاتر باعث غیر فعال شدن سیستم های آنزیمی ضروری و نشت متابولیت های اساسی از دیواره سلولی می شوند.
تولید فنولیک توسط رقیق سازی AOAC
گزارش های منتشر شده در مورد اثر ضد میکروبی فنل های متداول نشان می دهد که آنها دارای اثر ضد باکتری، قارچ کش، ضد ویروس و ضد سل هستند. یک مطالعه نشان داده است که فنولیک اثر ویروس کشی کمی را در مقابل کوکساکی B4، اکوویروس ۱۱ و پولیو ویروس ۱ دارد. به طور مشابه، ۱۲٪ ارتو فنیل فنول پس از مدت زمان ۱۰ دقیقه تماس در غیرفعال کردن هر یک از سه ویروس آبدوست ناموفق بود، اگرچه ۵٪ فنل برای این ویروس ها کشنده بود.
رقت ۰.۵٪ از فنولیک (۲.۸٪ ارتو فنیل فنول و ۲.۷٪ ارتو بنزیل-پار-کلروفنول) جهت غیر فعال نمودن HIV و یک محلول ۲٪ یک فنولیک (۱۵٪ ارتو فنیل فنول و ۱۵/۶٪ پارا سوم-آمیل فنل) جهت غیرفعال نمودن همه به جز یکی از ۱۱ قارچ بیماری زا مورد آزمایش قرار گرفتند.
داده های تولید کنندگان با استفاده از روشهای استاندارد AOAC نشان می دهد که فنل های تجاری اسپور کش نیستند بلکه در رقیق کردن توصیه شده، سل، سموم قارچی، ضد ویروس و ضد باکتری هستند. تلاش برای اثبات ادعاهای برچسب ضد باکتری فنلیک ها با استفاده از روش استفاده و رقیق سازی AOAC گهگاه شکست خورده است. با این حال، نتایج حاصل از همین مطالعات مشابه در بین آزمایشگاه های آزمایش محصولات یکسان متفاوت بوده است.
کاربرده ضدعفونی کننده فنولیک در سطوح متفاوت
بسیاری از میکروب کش های فنولیک به عنوان ضد عفونی کننده برای استفاده در سطوح محیطی (به عنوان مثال میزهای کنار تختخواب، بسترها و سطوح آزمایشگاهی) و دستگاه های پزشکی غیر حساس به عنوان ضد عفونی کننده در استاندارد EPA تایید شده است.
فنل ها به عنوان ضد عفونی کننده های سطح بالا در استاندارد FDA تایید نمی شوند بلکه می توانند برای پیشگیری یا ترمیم آلودگی دستگاه های حساس و بحرانی قبل از استریل کردن یا ضد عفونی سطح بالا مورد استفاده قرار گیرند.
استفاده از فنلیک ها در شیرخوارگاه به دلیل چربی خون در نوزادانی که در شستشوهایی که در آن از مواد شوینده فنولیک استفاده شده است، زیر سوال رفته است. علاوه بر این میزان بیلی روبین در مقایسه با نوزادان غیرفنولی در معرض افزایش میزان فنیل در نوزادان در معرض فنولی افزایش می یابد، هنگامی که فنولیک مطابق با رقت توصیه شده تولید کنندگان تهیه شد.
اگر از فنولیک ها برای تمیز کردن کف شیرخوارگاه استفاده می شود، آنها باید مطابق توصیه شده در برچسب محصول رقیق شوند. فنلیک ها (و سایر مواد ضد عفونی کننده) نباید برای تمیز کردن بیس ها و انکوباتورهای نوزاد در حین اشغال استفاده شوند.
در صورت استفاده از فنولیک برای تمیز کردن پایانی دستگیره های شیرخوار و انکوباتور، باید سطوح آن را با آب شستشو دهید و قبل از استفاده مجدد بسکت های نوزاد و انکوباتور را خشک کنید. شما می توانید انواع متفاوت مواد شیمیایی ضد عفونی کننده را از گروه تصفیه فاضلاب اوژن خریداری نمایید.
کلرامین (Chloramine) موثر در فرآیند تصفیه آب و فاضلاب
از ابتدای قرن بیست و یکم طعم و بوی آب آشامیدنی با استفاده از کلرامین (Chloramine) به میزان زیادی بهبود یافته است و سپس از این ماده برای ضدعفونی کردن آب استفاده شد.
خواص کلرامین ها میان کلر (Cl2) و آمونیاک (NH3)
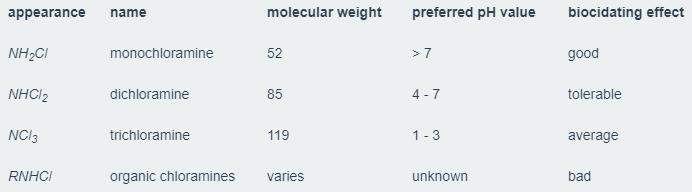
کلرامین ها از واکنش شیمیایی میان کلر (Cl2) و آمونیاک (NH3) به وجود می آیند. کلرامین ها در واقع آمین هایی هستند که با داشتن حداقل یک اتم کلر به طور مستقیم به اتم های نیتروژن پیوند دارند. Chloramine غیر آلی هنگام واکنش کلر حل شده و آمونویم، تشکیل می شوند. در طی این واکنش سه کلرامین غیر آلی متفاوت شکل می گیرد: مونوکلروامین(NH2Cl)، دی کلروامین (NHCl2) و تری کلروامین NCl3).
کلرامین های غیر آلی، کلر آزاد و کلرامین های آلی از لحاظ شیمیایی با یکدیگر مرتبط هستند و می توانند به راحتی به یکدیگر تغییر کنند. این ترکیبات به صورت جداگانه یافت نمی شوند. کلرامین های معدنی پایدار نیستند، با این حال، این ترکیبات ماندگارتر از ترکیبات کلر آزادانه در دسترس هستند. تحقیقات نشان می دهد که نیمه عمر کلرامین های معدنی براساس شرایط می تواند از یک دقیقه تا ۲۳ روز متغیر باشد.
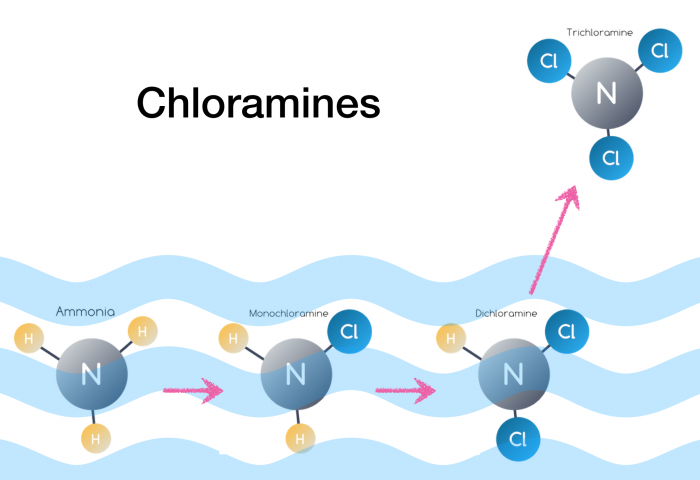
تولید کلرامین ها با افزودن آمونیاک به آب حاوی کلر
Chloramine غالباً با افزودن آمونیاک به آب حاوی کلر آزاد (HOCl یا (OCl با توجه به اندازه pH تولید می شود. مقدار pH ایده آل برای این واکنش ۸،۴ بوده و این بدان معنی است که آب کمی قلیایی می باشد.
مکانیسم واکنش: NH3 (aq) + HOCI ==> NH2Cl + H2O
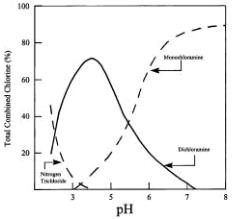
هنگامی که واکنش اتفاق می افتد، سه نوع Chloramine غیر آلی شکل می گیرد و مقدار pH تعیین خواهد کرد که کدام نوع Chloramine تشکیل شود. تری کلروامین ها به طور عمده زمانی به وجود می آیند که مقدار pH 3 یا پایینتر باشد. هنگامی که مقدار pH معادل ۷ یا بالاتر باشد و مونوکلرامین غلظت پایین تری دارد.
مقادیر کلر و آمونیاک موجود در آب نیز در منشأ Chloramine تأثیر دارد. نسبت کلر به آمونیاک در حالت ایده آل ۶ : ۱ و در طول تولید Chloramine این نسبت معمولاً ۳- ۵: ۱ است. هنگامی که غلظت آمونیاک بیشتر باشد، دی و تری کلرامین بیشتری تشکیل خواهد شد. کلرامین های آلی نیز در طی این واکنش ها می توانند تشکیل گردند. با استفاده از روش های استاندارد تجزیه و تحلیل مواد، کلرامین های آلی از سایر قابل تشخیص نیستند.
کاربردهای Chloramine نسبت به هیپوکلریت
کلرامین ها به عنوان سفید کننده، ضد عفونی کننده و اکسید کننده دارای کاربرد هستند. ضد عفونی کننده های آلی به آرامی کلر را از بین می برند و نسبت به هیپوکلریت ضد عفونی کندتر و تهاجمی کمتری دارند. هنگامی که از کلر به عنوان ضد عفونی کننده استفاده می شود.
Chloramine برای بهبود بو و طعم آب نیز مورد استفاده قرار می گیرد. از دیگر کاربردهای کلرامین ها می توان به ضد عفونی آب آشامیدنی و فاضلاب و همچنین مقاومت در برابر سوخت های زیستی در سیستم های خنککننده آب، اشاره نمود.
فرآیند ضد عفونی آب توسط ضد عفونی کننده آمونیاک
پس از افزودن Chloramine به عنوان ضد عفونی کننده آمونیاک اضافه می گردد. دلیل اضافه کردن آمونیاک پس از کلر این است که مقادیر CT پایینتر از زمانی خواهد بود که آمونیاک در ابتدا افزوده می شود.
کلرامین ها به اندازه کلر برای غیرفعال کردن باکتری ها و سایر میکروارگانیسم ها تاثیر دارند با این تفاوت که واکنش با سرعت کمتری انجام می پذیرد. این ماده مانند کلر اکسید کننده هستند و با نفوذ به دیواره سلولی و انسداد متابولیسم باکتری ها را از بین می ببرند. مونوکلرامین مؤثرترین ضد عفونی کننده است.
این ماده به طور مستقیم با اسیدهای آمینه در DNA باکتری ها واکنش نشان می دهد. در هنگام غیرفعال کردن میکروارگانیسم ها، Chloramine پوسته ای را محافظت می کند که محافظ ویروس است. هنگامی که مقدار pH برابر ۷ یا بالاتر باشد، مونوکلرامین فراوانترین کلرامین خواهد بود. مقدار pH با تأثیر کلرامین ها تداخلی ندارد.
در ایالات متحده Chloramine بیشتر به عنوان جایگزینی برای کلر در حین ضد عفونی آب آشامیدنی به کار می روند. در سال ۲۰۰۲، ۲۰٪ از شرکتهای تولید آب آشامیدنی ایالات متحده از کلرامین استفاده می کردند. دلیل اصلی انتقال از کلر به کلرامین این است که این ترکیب با ماده آلی کمتر از کلر واکنش نشان می دهند.
در طول ضدعفونی با این روش مقدار بسیار کمی از تری هالومین ها (THM) و سایر محصولات ضدعفونی کننده شکل می گیرد. به دلیل طولانی بودن تجزیه Chloramine، این مواد به مدت طولانی تری درون لوله کشی باقی می مانند. کلرامین ها بدون هر گونه بو و مزه بوده و نسبتاً بی خطر هستند. این مواد کلردار برای ضد عفونی برج خنککننده آب خیلی مناسب نیستند، زیرا این ترکیبات با میکروارگانیسم های بیماری زا بسیار کند واکنش نشان می دهند.
جرمی ساید (germicide) فعال در حوزه تصفیه فاضلاب بهداشتی
جرمی ساید محصولی ضد عفونی کننده برای استفاده در حوزهی دامپزشکی، بیمارستانی و خانگی است که برای از بین بردن اکثریت میکروارگانیسم ها، قارچ ها و عوامل بیماری زا بر روی سطوح و وسایل مختلف و حتی زخم و برشهای سطحی دام ها و حیوانات استفاده میشود.
ضدعفونی کننده جرمی فعال در نابودی انواع طیف میکروارگانیسم ها
جرمی ساید در دسته ی محصولات ضد عفونی کننده غیر اختصاصی است که سرعت عمل بالایی داشته و علاوه بر سازگاری با دترجنت ها، سمیتی برای انسان و حیوانات ندارد. شیوه ی استفاده از این محصول راحت بوده و فعالیت بسیار خوبی نیز بر روی سطوح دارد. با توجه به قدرت کشندگی جرمی ساید در طیف مختلفی از میکروارگانیسمها، آنها را در دستههای High ،Intermediate و Low قرار می دهند که به ترتیب قدرت کشندگی آن ها کاهش می یابد.

عملکرد جرمی ساید وابسته به مواد تشکیل دهنده غشاها
عملکرد کلی محصول جرمی ساید بسته به نوع مواد تشکیل دهنده و ساختار آن متفاوت است که در سه دستهی فوق آن ها را قرار میدهد. برخی از انواع جرمی ساید از طریق از بین بردن غشای سلولی و پروتئینهای بسیار مهم غشایی باعث از بین رفتن میکروارگانیسمها میشوند در حالیکه در انواع با درصد بالاتری از الکل، از طریق دناتوراسیون پروتئین ها عمل میکنند.
مواردی که ید زیادی دارند با اختلال در عملکرد غشای سلولی عمل خواهند کرد. لذا شیوه ی عملکرد جرمی ساید که محصولی در قالب یک عنوان کلی است متفاوت بوده و بسته به مواد تشکیل دهنده، روش کار متفاوتی دارد.
کاربرد ضدعفونی کننده جرمی ساید در حوزه های گوناگون
جرمی ساید کاربرد بسیار گسترده ای دارد و برای استفاده در محل های مختلف مانند دامپزشکی، خانگی و بیمارستانی فرمولاسیون های متفاوتی برای آن در نظر گرفته میشود تا به تمیزسازی و پاکسازی سطوح مختلف پرداخته شود. از جرمی ساید برای ضد عفونی کردن وسایل و قسمت های مختلف مراقبت از سلامت، وسایل نگهداری و معاینه ی حیوانات، ضد عفونی سازی محل های زخم، پاکسازی بخش های مختلف سالن های نگهداری و پرورش حیوانات و غیره استفاده میشود.
البته توجه داشته باشید که هنگامی میتوان انتظار کاربرد بسیار مؤثر و قدرت بالایی از جرمی ساید داشت که دقیقا طبق دستورالعمل ساخته شده باشد و تمامی موارد مرتبط رعایت گردند. این محصول جز بهترین محصولات با طیف عملکردی گسترده است که به دلیل عمل بر روی تمامی عوامل آلوده کننده، غیر اختصاصی نامیده میشود.

ویژگی شیمیایی جرمی ساید از نظر ساختار شیمیایی
ویژگیهایی که این محصول را از سایر عوامل ضد عفونی کننده متمایز ساخته است عبارتند از:
- طیف عملکردی بسیار گسترده و قابل کاربرد بر روی تمامی میکروارگانیسمها از جمله باکتریهای گرم مثبت مقاوم
- سرعت عمل بسیار بالا به نحوی که پس از چند دقیقه عمل پاکسازی آن صورت میگیرد
- فاکتورهای زیست محیطی بر روی آن تأثیرگذار نیست به عنوان مثال برای استفاده از این محصول نیاز به پاکسازی کامل سطوح و قسمتهای مختلف موجود زنده با الکل و غیره نیست و حتی در صورت وجود عوامل مختلف نیز، قدرت عمل خود را حفظ میکند.
- به هیچ وجه استفاده از آن برای حیوانات و کادر درمانی و مراقبتی سمّیت ندارد و حتی در دامپزشکی استنشاق و برخورد آن با پوست بدن خطرناک نیست.
- بر روی تمامی وسایل و دستگاه ها میتوان به کار برد بدون اینکه باعث از بین رفتگی سطح آنان گردد.
- بدون بو بوده و برخلاف برخی مواد ضد عفونی کنندهی دیگر، بوی اذیت کنندهای ندارد.
- محلول در آب است و فرم جامد برای استفاده کردن ندارد.
- کاملا ساختار شیمیایی جرمی سایدپایدار است و در صورت رعایت شرایط دمایی، بر روی سطوح و بخشهای مختلف باقی خواهد ماند.
- تهیهی آن از لحاظ اقتصادی مقرون به صرفه است و نیازی به پرداخت هزینههای سنگین نیست.
- استفاده از آن نیاز به دانش تخصصی بالایی ندارد و کافیست درجه رقت نهایی محصول را مطابق با دستورالعمل بسازید که توضیحات آن کاملا واضح و قابل فهم هستند.
شرایط نگهداری جرمی ساید جهت جلولگیری از آسیب شیمیایی
همانطور که گفتیم این محصول باید تحت شرایط محیطی مورد نظر و تعیین شده برای آن قرار گیرد تا آسیبی به ساختار شیمیایی آن وارد نشود، چرا که در این صورت قدرت کشندگی و اثربخشی آن به شدت کاهش خواهد یافت. طبق دستورالعمل شرکت های سازنده همیشه محلول این محصول باید در بسته بندی اولیهی خود باشد و به هیچ ظرف دیگری نباید انتقال داده شود. دما را زیر ۳۰ درجهی سانتی گراد نگه دارید به نحوی که دمای بالای محیط یا تابش مستقیم خورشید سبب شکست ساختار آن نشود و دما نیز به زیر صفر درجه نرسد.

نحوهی مصرف جرمی ساید بر حسب نوع کاربرد
نحوهی مصرف محصول جرمی ساید برحسب نوع کاربرد و ترکیبات مختلف مواد کشنده ای که در داخل آن حتی با نسبت های مختلف قرار داده شده متفاوت خواهد بود، اما در مورد مصرف این محصول به طور کلی باید نکات زیر را در نظر داشته باشید:
- مدت زمان: حتما هنگام مصرف به مدت زمان توصیه شده دقت کنید. این مقدار مدت زمانی است که باید بر روی سطوح مختلف یا اطراف زخم حیوانات و غیره بماند تا بیشترین اثر ضد عفونی کنندگی را داشته باشد.
- شستن صحیح محل: پس از اینکه مدت زمان توصیه شده سپری شد، حتما باید محلهایی که با آن ضد عفونی شدن صورت گرفته شستشو داده شود. به عنوان مثال قفس حیوانات و یا محل اطراف رفت و آمد و زندگی آن ها، سطوح و وسایل مختلفی که در کلینیکها و غیره برای ضد عفونی شدن استفاده شده، همگی باید به خوبی شستشو داده شوند.
- انتقال آلودگی: در نحوه و دستورالعمل مصرف این محصولات ذکر شده که تا زمان ضد عفونی شدن به هیچ وجه بین محلهای تمیز و ضد عفونی نشده رفت و آمد نداشته باشید.
- نسبت ترکیب: برخی از شرکتهای سازندهی جرمی ساید این محصول را به صورت ترکیب شده و آماده عرضه میکنند و برخی دیگر نیز فقط ماده مؤثر را به فروش میرسانند تا هر بار برای مکانهای مختلف، با نسبتهای جداگانه تهیه کنید. حتما به نسبتهای توصیه شده در کاتالوگ و توضیحات محصول دقت کنید در غیر این صورت قدرت کشندگی خود را از دست می دهند.

موارد منع مصرف جرمی ساید در دامداری ها
با وجود امن بودن جرمی ساید برای کلیه ی دام ها و حیوانات، بیمارستانها و کادر پرسنلی در برخی مواقع شرایط منع مصرف وجود دارد به عنوان مثال در دامداریها توصیه شده که هنگام واکسیناسیون، تا ۲۴ ساعت قبل و بعد از آن استفاده نشود. در انواعی که حاوی مقدار زیادی کلرین هستند، از هرگونه تماس آن با چشم و حلق باید خودداری شود.
همچنین برخی از آنها برای عمل کردن و اثربخشی بالا، حتما باید سطوح از قبل با الکل پاک شده باشند در غیر این صورت نباید استفاده کرد. در صورت خرید و استفاده از این محصول و دیگر مواد شیمیایی می توانید با کارشناسان گروه اوژن تماس حاصل فرمائید.
برومین مخرب مواد آلی
برم یا برومین عدد اتمی ۳۵ دارد. مانند کلر، هالوژن است و به راحتی با عناصر دیگر واکنش نشان می دهد. در طبیعت این عنصر تنها در ترکیبات یافت می شود. به این ترکیبات این عنصر برمید گفته می شود. از این ترکیبات برای به دست آوردن برم خالص و تولید محصولات آن استفاده می شود.
پس از فلوئور، برومین واکنش پذیرترین عنصر است. با بسیاری از مواد مختلف واکنش نشان می دهد، روی مواد آلی بسیار خورنده و مخرب است. از برم می توان برای ضد عفونی کردن استخر شنا و برج آب خنککننده استفاده کرد. از این ماده برای ضد عفونی کردن آب آشامیدنی استفاده نمی شود.
خصوصیات برم چیست؟
برومین تنها عنصر غیر فلزی است که در دمای اتاق و فشار استاندارد مایع است. این ماده یک مایع قرمز است که به راحتی تبخیر و بو می کند. برم تقریبا ۳،۱۲ برابر سنگین تر از آب است. در دمای ۵۸.۸ درجه سانتیگراد آن را گازی می کند، در حالی که در ۷،۳- درجه سانتی گراد و دمای پایینتر یک جامد است.

برومین در حالت مایع سمی بوده و بخار آن برای پوست، چشم ها و مجاری تنفسی انسان مخرب است. باعث سوختگی جدی می شود. غلظت ۱ ppm می تواند باعث آب شدن چشم شود و هنگامی که استنشاق غلظت های زیر ppm10 اتفاق می افتد، فرد شروع به سرفه می کند و مجاری تنفسی تحریک می شود.
برم به راحتی در آب حل می شود (۳۵ گرم در لیتر آب)، دی سولفید کربن و سایر محلول های آلی هنگامی که به آب اضافه می شود، برم اسید هیپوبروم تشکیل می دهد. اسید Hyprobromous یک اسید ضعیف است. این مایع تا حدی از هم جدا می شود تا یون های هیدروژن و یون های هیپوبرومیت تشکیل شود. میزان یونهای اسید هیپوبروم و هیپوبرومیت با مقدار pH آب تعیین می شود. وقتی مقدار pH بین ۶.۵ و ۹ باشد، هر دو یون هیپوبروم و اسید هیپوبرومیت در آب یافت می شوند.
اگر آب حاوی نیتروژن آمونیاک باشد، برومین ها تشکیل می شوند (NH۲Br، NHBr۲ و NHBr۳). برای ضد عفونی کردن، برومین ها به اندازه اسید هیپوبروم موثر هستند. تغییر مقدار pH بر میزان مونو، دی و تری برومین هایی که تشکیل می شود تأثیر می گذارد.
برم کجا یافت می شود؟
در طبیعت این عنصر به عنوان نمک برمید یا مواد آلی برم یافت می شود. این مواد توسط چندین ارگانیسم دریایی تولید می شوند. این عنصر بیشتر در نمک های محلول در آب دریا، دریاچه های نمکی و آب نمک است. آب دریا حاوی تقریباً ppm65 برومین است. غلظت برومین موجود در آب نمک بسیار بیشتر است، بین ۲۵۰۰ تا ۱۰۰۰۰ پی پی ام.

کاربردهای برم چیست؟
اولین کاربرد شناخته شده از محصول حاوی برم، تولید رنگ بنفش است. این ماده توسط حلزون های بنفش تولید می شود و توسط رومی ها مورد استفاده قرار گرفت تا لباس های خود را به رنگ بنفش بکشند. امروزه برومین کاربردهای زیادی دارد. در صنعت و کشاورزی از آن در مقیاس وسیع برای تولید مواد حاوی برم استفاده می شود.
از این عنصر به طور عمده برای تولید دیبلومید اتیلن استفاده می شد. مواد تشکیل دهنده سوخت حاوی سرب. این محصول به دلیل اثرات مضر بر محیط زیست، دیگر مورد استفاده قرار نمی گیرد. برومین در بازدارنده های شعله برمیده، داروها، عکاسی، تولید روغن، رنگها و سموم دفع آفات کاربرد دارد. در تصفیه آب از برومین به عنوان گزینه ای برای ضد عفونی کننده استخر استفاده می شود.
آیا می توان از برم برای ضد عفونی استخرها استفاده کرد؟
مواد برم ضد عفونی کننده هستند و می توانند به عنوان جایگزینی برای کلر استفاده شوند. در استخرهای شنا از برومین در مقابل شکل گیری و رشد جلبک ها، باکتری ها و بو در آب شنا استفاده می شود. در ایالات متحده، از سال ۱۹۳۶ برای تهیه آب استخر ها از آب برم استفاده شده است. در طول جنگ جهانی دوم، کلر کمیاب شد و بسیاری از استخرهای شنا به جای آن از برم برای ضدعفونی آب استفاده کردند.
این عنصر را می توان به صورت مایع یا مخلوط استفاده کرد. هنگامی که برومین به صورت مایع اعمال می شود ، معادله زیر برقرار می شود:
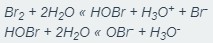
این معادله به مقدار pH بستگی دارد. در مقدار pH که معمولاً در استخرهای شنا یافت می شود ، برم عمدتاً به عنوان اسید هیپوبروم (HOBr) موجود است. باید از این عنصر در ترکیب با یک ماده اکسید کننده (به عنوان مثال کلر یا ازن) استفاده شود.
پس از ضد عفونی و اکسیداسیون برومین آزاد باقی می ماند. هنگامی که BCDMH (Bromine-chlorine-dimethylhydantoine) در آب حل می شود، اسید هیپوبروم و اسید هیپوکلروز آزاد می شوند. این مواد با برمیدها واکنش نشان می دهند و باعث تولید اسید هیپوبروم اضافی می شود.
به همین دلیل می توان از برم هم به عنوان ضد عفونی کننده و هم به عنوان ماده اکسید کننده استفاده کرد. غلظت BCDMH در آب نباید به ۲۰۰ میلی گرم در لیتر یا بالاتر برسد، در غیر این صورت تعادل بین ضد عفونی کننده باقیمانده و ماده آلی مختل می شود. مزیت BCDMH این است که هنگام ذخیره آن بی ضرر است. استفاده از آن آسان بوده و گاهی اوقات، باید مقدار pH آن تنظیم شود.
BCDMH به صورت قرص یا کارتریج تهیه می شود. ماندگاری طولانی دارد و خیلی آرام حل می شود. سیستم دیگری که قابل استفاده است حل کردن نمک برم (سدیم برمید) در آب و فعال کردن آن با افزودن اکسیداتور (هیپوکلریت یا ازن) است. در ابتدا نمک به آب اضافه می شود. دوم، برای فعال کردن برم اکسیداتور اضافه می شود و اسید هیپوبروم تشکیل می شود.
در حین ضد عفونی، اسید هیپوبروم در یون های برمید جدا می شود. این یونها می توانند دوباره فعال شوند. برم با دیگر مواد موجود در آب واکنش نشان می دهد تا مواد حاوی برم را تشکیل دهد. این مواد ضد عفونی کننده هستند و بو نمی دهند. برومین ، آمونیاک یا سایر مواد ازت را اکسیده نمی کند. اسید هیپوبروم با نور خورشید واکنش نشان می دهد.
هنگامی که مقدار pH بین ۷ تا ۸،۵ دیبرومامین است شایع ترین شکل برم است. دیبروموامین تقریباً به اندازه کلر آزاد در کشتن میکروارگانیسم ها مؤثر است. Dibromoamine بسیار فعال است و معمولاً به سرعت در یون های برمید جدا می شود. به همین دلیل، هیچ برمی در آب باقی نمی ماند.

مهمترین مواد برومید مورد استفاده به عنوان زیست توده، سدیم برمید و BCDMH هستند.
آیا می توان از برم برای ضد عفونی آب آشامیدنی استفاده کرد؟
برم آزاد (Br۲) در تصفیه آب آشامیدنی استفاده نمی شود. این ماده به سرعت با مواد آلی واکنش نشان می دهد و هیچ باقیمانده ای باقی نمی ماند. برم آب آشامیدنی را به یک طعم وحشتناک مانند داروی می دهد. این عنصر فقط باید در موارد اضطراری استفاده شود.
آیا از برم برای ضد عفونی کردن آب برج خنککننده استفاده می شود؟
از برم می توان برای ضد عفونی کردن آب برج خنککننده استفاده کرد. اسید هیپوبروم در از بین بردن میکروارگانیسم ها کمی کمتر از اسید هیپوکلرو است. مقدار pH آب خنک کننده مشخص می کند کدام فرم از این عنصر موجود است. وقتی مقدار pH زیر ۸،۷ باشد، اسید هیپوبروم بیشتر (HOBr) تشکیل می شود.
این نسبت به یون های هیپوبرومیت مؤثرتر است، که بیشتر از pH 8،۷ فراوان خواهد بود. به همین دلیل است که Bromine ماده ضد عفونی کننده ای بهتر برای آب برج خنک کننده قلیایی نسبت به کلر است. در pH 7،۶ و بالاتر، یونهای اصلی هیپوکلریت تشکیل می شوند.
این ها نسبت به اسید هیپوکلرو کمتر موثر هستند. برم با آمونیاک واکنش می دهد تا برومین ها را تشکیل دهند. برخلاف کلرامین ها، برومامین ها ناپایدار هستند و به اسید هیپوبروم تجزیه می شوند. تا زمانی که برم کافی وجود داشته باشد، بیشتر میکروارگانیسم های موجود در برجهای خنککننده با برم قابل درمان هستند.

مزایا و مضرات استفاده از این عنصر چیست؟
برم در آب سه برابر بهتر از کلر حل می شود. برای تولید آن هیچ گاز خطرناکی لازم نیست. فعالیت Bromine در آب کوتاه است، زیرا به شدت نمی چسبد. مزیت این است که غلظت باقیمانده کم است و هیچ ماده جداگانه ای برای از بین بردن آن لازم نیست.
این عنصر بسیار واکنش پذیر است. برای حفظ ضد عفونی کافی، مقدار برومین که اضافه می شود باید زیاد باشد. برومین با فلزات تهاجمی واکنش نشان می دهد و ماده ای خورنده است. در هنگام حمل و نقل، ذخیره یا استفاده از آن، اقدامات امنیتی باید انجام شود.
تشکیل برومین توسط آمونیاک
برومین هایی که با افزودن Bromine به آب غنی از آمونیاک تشکیل می شوند به همان اندازه کلر آزاد در کشتن میکروارگانیسم های بیماری زا موثر هستند.
اثرات سلامتی مصرف برومین چیست؟
غلظت برم در حدود ۰.۵ میلی گرم در لیتر در استخرها باعث سوزش غشای چشم و مخاط می شود و می تواند به بو منجر شود. در طبیعت Bromine در مواد معدنی یافت می شود. در طول قرن بیستم، انسان برای چندین کاربرد برومین آلی تولید کرده است. برم ارگانیک ماده طبیعی نیست و صدمات شدیدی به محیط می زند.
انسانها می توانند این عنصر را از طریق پوست، جذب مواد غذایی و استنشاق به دست آورند. از آن به عنوان اسپری برای از بین بردن حشرات و سایر آفات ناخواسته استفاده می شود. برم ارگانیک برای انسان و حیوان خطرناک است. این غده تیروئید، مواد ژنتیکی و سیستم عصبی را تحت تأثیر قرار می دهد.
اثرات زیست محیطی مصرف برومین ها
این عنصر به عنوان ضد عفونی کننده استفاده می شود، زیرا برای میکروارگانیسم ها مضر است. هنگامی که برم آلی وارد آبهای سطحی می شود، تأثیرات منفی بر سلامت آب، ماهی ها، خرچنگ ها و جلبک ها دارد. هنگامی که از برومین برای ضدعفونی کردن آب استفاده می شود ،برومین ها و اسید هیپوبروم با ماده آلی موجود در آب واکنش نشان می دهند تا محصولات جانبی ضد عفونی کننده Bromine را تشکیل دهند. اینها می توانند برای سلامتی انسان مضر باشند.
قانون استفاده از برم چگونه است؟
اتحادیه اروپا در فرانسه از برم برای ضد عفونی کردن استخرها استفاده می شود. استاندارد فرانسوی برای برومین در استخرهای شنا ۷/۰ میلی گرم در لیتر است. غلظت ۵/۰ میلی گرم در لیتر باعث تحریک غشاهای مخاطی، چشم ها و مزاحمت های بو می شود.
پراکسید هیدروژن یا آب اکسیژنه (hydrogen peroxide) کاتالیزور قوی
بیشتر افراد پراکسید هیدروژن یا آب اکسیژنه را به عنوان ترکیبی که باعث سفید شدن مو می شود، می شناسند. همچنین می توان از آن برای ضد عفونی آب استفاده کرد.
چه زمانی پراکسید هیدروژن کشف شد؟
لوئیس ژاک تارد در سال ۱۸۱۸ پراکسید هیدروژن را کشف کرد. این ماده از اتم های اکسیژن و هیدروژن تشکیل شده است. این اتم ها را می توان در همه جای زمین یافت. آب اکسیژنه شامل ترکیبی از دو اتم هیدروژن و دو اتم اکسیژن است. در محیط زیست، پراکسید هیدروژن در غلظت های بسیار کم یافت می شود. این ماده گازی با عکسبرداری واکنشهای شیمیایی در جو پیرامون زمین تولید می شود. این ماده همچنین به مقدار کم در آب یافت می شود.
خصوصیات آب اکسیژنه چیست؟
پراکسید یک ترکیب شیمیایی است که حاوی یون پراکسید (O۲۲-) است. یون پراکسید از یک پیوند واحد بین دو اتم اکسیژن تشکیل شده است: (O-O)۲- این یک اکسید کننده قوی است. آب اکسیژنه دارای فرمول شیمیایی H۲O۲ و فرمول ساختاری H-O-O-H است.
مولکول پراکسید هیدروژن حاوی یک اتم اکسیژن اضافی، در مقایسه با مولکول آب با ثبات تر است. پیوند بین دو اتم اکسیژن، به اصطلاح پیوند پراکسید، شکسته می شود در حالی که دو رادیکال H-O تشکیل می شود. این رادیکال ها به سرعت با سایر مواد واکنش نشان می دهند، در حالی که رادیکال های جدید تشکیل می شوند و یک واکنش زنجیره ای اتفاق می افتد.
محلول های H۲O۲ مانند آب به نظر می رسند و به طور نامحدود در آب حل می شوند. در غلظت های بالا این محلول ها بوی اسیدی و تحریک کننده می بخشد. آب اکسیژنه قابل اشتعال است و در دماهای پایین جامد می شود. مقدار هیدروژن پر اکسید موجود در محلول در درصد وزن بیان می شود. برای تصفیه آب از غلظت ۳۵ یا ۵۰٪ آب اکسیژنه استفاده می شود.

خاصیت گزینشی آب اکسیژنه
پراکسید هیدروژن برای کاربردهای مختلف مورد استفاده قرار می گیرد. با تغییر شرایط واکنش (دما، pH، دوز، زمان واکنش و افزودن کاتالیزور)، این ماده به آلودگی های مختلف حمله می کند.
خوردگی پراکسید هیدروژن به دلیل اکسید شدن
خوردگی آب فرآوری شده به دلیل پر اکسید هیدروژن به میزان اکسیژن محلول تولید شده بستگی دارد. اکسیژن باعث خوردگی فلزات حاوی آهن می شود. مقدار آهن و pH تأثیر بیشتری در میزان خوردگی از غلظت پراکسید هیدروژن دارد.
تخریب هیدروژن پر اکسید در طول حمل و نقل
هیدروژن پر اکسید می تواند در طول حمل و نقل تجزیه و اکسیژن و گرما آزاد شود. این ماده ضدعفونی به خودی خود ملتهب است، اما اکسیژن می تواند التهاب سایر مواد را تقویت کند. در محلول های رقیق، گرما توسط آب جذب می شود. در محلول های غلیظ، دمای محلول افزایش می یابد و باعث تسریع در تخریب پر اکسید هیدروژن می شود.
میزان تخریب برای هر ۱۰ درجه سانتیگراد افزایش دما با ۲،۲ ضرب می شود. قلیایی و وجود آلودگی نیز باعث از بین رفتن هیدروژن پراکسید می شود. برای تولید پر اکسید هیدروژن از کاتالیزورهای ویژه استفاده می شود تا اطمینان حاصل شود که این ماده توسط آلاینده های موجود در آب از بین نمی رود.
هیدروژن پر اکسید چگونه تولید می شود؟
از سال ۱۸۸۰، پراکسید هیدروژن یک محصول تجاری است. این برای اولین بار در انگلستان با سوزاندن نمک باریم (Ba)، که پراکسید باریم (BaO2) تولید می کرد. پس از آن پراکسید باریم در آب حل و ماده آب اکسیژنه تولید شد. از قرن نوزدهم تولید پراکسید هیدروژن تا حد زیادی افزایش یافته است. امروزه سالانه حدود نیم میلیارد کیلوگرم تولید می شود.

حمل و ذخیره پر اکسید هیدروژن
پر اکسید هیدروژن باید در ظروف پلی اتیلن، فولاد ضد زنگ یا آلومینیوم منتقل شود. هنگامی که پر اکسید هیدروژن با مواد قابل اشتعال مانند چوب، کاغذ، روغن یا پنبه (سلولز) در تماس باشد، ممکن است احتراق خود به خود ایجاد شود. هنگامی که پراکسید هیدروژن با مواد آلی مانند الکلها، استون و سایر کتونها، آلدهیدها و گلیسرولها مخلوط شود، ممکن است انفجارهای سنگینی رخ دهد.
وقتی پراکسید هیدروژن با موادی مانند آهن، مس، کروم، سرب، نقره، منگنز، سدیم، پتاسیم، منیزیم، نیکل، طلا، پلاتین، متالوئیدها، اکسیدهای فلزی یا نمکهای فلزی در تماس باشد، این ممکن است منجر به انفجارهای قدرتمند شود. به همین دلیل است که پراکسید هیدروژن معمولاً به شکل رقیق شده منتقل می شود.
کاربردهای پر اکسید هیدروژن چیست؟
قدیمی ترین کاربرد شناخته شده پر اکسید هیدروژن سفیدکردن کلاه های حصیری بود، که در آغاز قرن بیستم شیک بودند. از سال ۱۹۲۰ تا ۱۹۵۰، پراکسید هیدروژن از طریق الکترولیز تولید شد. امروزه از فرآیندهای خود اکسیداسیون برای تولید آب اکسیژنه استفاده می شود. در طی این فرایندها، هیدروژن ماده اولیه است.
تطبیق پذیری پراکسید هیدروژن
هیدروژن پر اکسید همه کاره است، می تواند برای بسیاری از کاربردها مورد استفاده قرار گیرد. می توان از آن در کلیه موارد استفاده کرد. هوا، آب، فاضلاب و خاک. گاهی اوقات همراه با عوامل دیگر، برای تقویت و تسریع فرآیندها مورد استفاده قرار می گیرد.
پراکسید هیدروژن بیشتر برای از بین بردن آلاینده ها از پساب و هوا استفاده می شود. این رشد باکتری (به عنوان مثال رسوب زیستی در سیستم های آبی) را به چالش می کشد و می تواند با افزودن اکسیژن رشد باکتریها (به عنوان مثال اصلاح زیستی خاکهای آلوده و آبهای زیرزمینی) را تقویت کند.
همچنین می توان از آن برای تصفیه آلودگی هایی استفاده کرد که به راحتی اکسیده شوند (به عنوان مثال آهن و سولفیدها) و آلودگی هایی که اکسیداسیون آنها دشوار است (به عنوان مثال مواد جامد محلول، بنزین و سموم دفع آفات).
سرانجام می توان از آن برای سفید کردن کاغذ، نساجی، دندان و مو یا تولید مواد غذایی، مواد معدنی، مواد پتروشیمی یا پودر لباسشویی استفاده کرد. به شکل خالص، آب اکسیژنه به عنوان یک منبع اکسیژن برای رانندگی زیردریایی های روسی استفاده می شود.
آیا می توان از آب اکسیژنه به عنوان اکسید کننده استفاده کرد؟
پراکسید هیدروژن یک اکسید کننده قوی است. از کلر (Cl۲)، دی اکسید کلر (ClO۲) و پرمنگنات پتاسیم (KMnO۴) قدرت بیشتری دارد. از طریق کاتالیز، این ماده را می توان به رادیکال هیدروکسی (OH) تبدیل کرد. پتانسیل اکسیداسیون آب اکسِزنه کمتر از ازن است.
| ردیف | اکسید کننده | نام لاتین | فرمول شیمیایی | پتانسیل اکسیداسیون |
| ۱ | فلورین | fluorine | F– | ۳.۰ |
| ۲ | رادیکال هیدروکسی | hydroxyradicals | OH | ۲.۸ |
| ۳ | ازن | ozone | O۳ | ۲.۱ |
| ۴ | پراکسید هیدروژن | hydrogen peroxide | H۲O۲ | ۱.۸ |
| ۵ | پرمنگنات پتاسیم | potassium permanganate | KMnO۴ | ۱.۷ |
| ۶ | دی اکسید کلر | chlorine dioxide | ClO۲ | ۱.۵ |
| ۷ | کلر | chlorine | Cl۲ | ۱.۴ |
محلول یدوفور ضدعفونی کننده پوست و بافتهای گوناگون
محلول های ید یا تنتور از مدت ها قبل توسط متخصصان بهداشت به عنوان ضد عفونی کننده بر روی پوست یا بافت مورد استفاده قرار گرفته است. محلول های حاوی ید از قوی ترین ضدعفونی کننده های شناخته شده می باشند، به همین جهت معروف به هاپر کیلر هستند.
به طور تجربی این ترکیب ۲۷ بار قوی تر از هالامید، ۱۶بار قوی تر از ویروس کیلر، ۳۲بار قوی تر از آب اکسیژنه، ۵ بار قوی تر از مالاشیت گرین، ۶۰ بار قوی تر از فرمالین و ۳۰۰ بار قوی تر از نمک می باشد. انواع مواد شیمیایی ضد عفونی کننده را از شرکت اوژن اطلس تهیه کرده و در صورت وجود هر گونه سوال با کارشناسان ما در تماس باشید.
از طرف دیگر، از یدوفورها به عنوان ضد عفونی کننده و گندزدا استفاده شده است. FDA هیچ ماده ضد عفونی کننده شیمیایی مایع یا سطح بالایی را با یدوفورها به عنوان ماده اصلی فعال تایید نکرده است. ماده ضدعفونی کننده یدوفور ترکیبی از ید و ماده یا عامل حل کننده آن است. کمپلکس حاصل یک مخزن آزاد ید را فراهم می کند و مقادیر کمی ید آزاد را در محلول آبی آزاد می کند. شناخته شده ترین و پرکاربردترین یدوفور پودیدون-ید، ترکیبی از پلی وینیل پیرولیدون با ید است.
این محصول و سایر یدوفورها اثر ضد میکروبی ید را حفظ می کنند اما برخلاف ید عموماً بدون ضرر نیستند و نسبتاً عاری از سمیت و تحریک پذیری هستند. گزارش های متعددی که آلودگی میکروبی ذاتی در فرمول های ضد عفونی کننده پروویدون-ید و پولوکزامر-ید را ثبت کرده اند، باعث ارزیابی مجدد مواد شیمایی و استفاده از یدوفورها شده است.
ید آزاد (I2) به فعالیت ضد باکتری یدوفورها کمک می کند و رقیق کننده یدوفورها فرآیند باکتری کشی سریعتر را نسبت به محلول پودیدون-ید با قدرت کامل انجام می دهند.
دلیل این مشاهده که باعث افزایش فعالیت باکتری کش می شود، مشخص نیست، اما رقیق شدن ید-پوودون ممکن است ارتباط ید با پلیمر حامل را با افزایش همراهی ید آزاد در محلول تضعیف کند. بنابراین برای دستیابی به فعالیت ضد میکروبی باید یدوفورها طبق دستورالعمل های تولیدکننده رقیق شوند.
نحوه عملکرد ضدعفونی کننده یدوفور
ید می تواند به سرعت در دیواره سلولی میکروارگانیسم ها نفوذ کند و اعتقاد بر این است که اثرات کشنده ناشی از اختلال در پروتئین و ساختار اسید نوکلئیک و سنتز است.
مکانیزم میکروب زدایی یدوفورها
گزارش های منتشر شده در مورد اثر ضد میکروبی در شرایط ویترو در رابطه با یدوفورها نشان می دهد که یدوفورها ضد باکتری، مایکوباکتری کش و ویروس کش هستند، اما ممکن است زمان تماس طولانی مدت برای از بین بردن برخی قارچ ها و اسپورهای باکتریایی نیاز داشته باشند. سه برند محلول پیویدون-ید دارای سرعت ضدعفونی کنندگی سریعتری را (ثانیه تا دقیقه) جهت حذف سلول های S. aureus و M. chelonae را در رقت ۱۰۰:۱ نسبت به محلول خام نشان داده اند.
فعالیت ضد ویروس غلظت ۷۵-۱۵۰ ppm ید علیه هفت ویروس اثبات شده است. تحقیقات دیگری در مورد اثر یدوفورها در برابر پولیو ویروس در حضور ماده آلی و روتاویروس SA-11 در مقطر یا آب شیرین کن اثبات شده است. داده های تولیدکنندگان نشان می دهد که یدوفورهای تجاری اسپری کش نیستند، بلکه در رقیق کردن توصیه شده، سل کش، قارچ کش، ضد ویروس و باکتری کش هستند.
کاربردهای مختلف ضدعفونی کننده یدوفور
علاوه بر استفاده از آنها به عنوان ضد عفونی کننده، از یدوفورها برای ضدعفونی کردن بطری های کشت خون و تجهیزات پزشکی مانند مخازن هیدروتراپی، دماسنج و آندوسکوپ استفاده شده است. ضدعفونی کننده یدوفور به دلیل اختلاف غلظت برای استفاده به عنوان ضد عفونی کننده های سطح سخت مناسب نیستند.

یدوفورهایی که به عنوان گندزدا ساخته شده اند حاوی ید کمتری نسبت به آنهایی هستند که به عنوان ضد عفونی کننده تهیه شده اند. ضد عفونی کننده ید یا مبتنی بر ید نباید روی کاتترهای سیلیکون استفاده شود زیرا می توانند بر روی لوله سیلیکون تأثیر منفی بگذارند. شما می توانید انواع مواد ضد عفونی کننده را از شرکت اوژن اطلس سپهر خریداری نمایید.
گلوتارآلدهید آبی (glutaraldehyde) استریل کننده شیمیایی اسپورکش
ضدعفونی کننده گلوتارآلدهید یک در آلدهید اشباع است که به عنوان یک ماده ضد عفونی کننده سطح بالا و یک ماده استریل کننده شیمیایی پذیرش گسترده ای را کسب کرده است. محلول های آبی گلوتارآلدئید اسیدی هستند و به طور کلی در این حالت اسپور کش نیستند.
تنها هنگامی که محلول با استفاده از مواد قلیایی به pH 7.5-8.5 “فعال” (ساخته شده قلیایی) می شود، محلول به صورت اسپور کش تبدیل می شود. پس از فعال شدن، این محلول ها به دلیل پلیمریزاسیون مولکول های گلوتارآلدئید در pH قلیایی، ماندگاری حداقل ۱۴ روز دارند. این پلیمریزاسیون سایت های فعال (گروه های آلدهید) مولکول های گلوتارآلدهید را که وظیفه فعالیت ضدعفونی کردن را بر عهده دارند حفظ می کند.

فرمولاسیون های گلوتارآلدئید (به عنوان مثال، گلوتارآلدئید_فنل سدیم فنات، گلوتارآلدهید اسید، گلوتارآلدهید قلیایی تثبیت شده) بر مشکل از دست دادن سریع فعالیت (به عنوان مثال، استفاده از عمر ۲۸-۳۰ روز) و حفظ فعالیت میکروب کشی عالی تأثیر گذارده و در ۳۰ سال گذشته کشف شده است.
فعالیت ضد میکروبی نه تنها به سن محلول بلکه به شرایط استفاده مانند رقیق شدن و شوک آلی نیز بستگی دارد. ادبیات تولید کنندگان برای این آماده سازی ها حاکی از آن است که گلوتارآلدهید های خنثی یا قلیایی دارای خواص میکروبی کش و ضد خوردگی نسبت به گلوتارالدئیدهای اسیدی هستند و چند گزارش منتشر شده این ادعاها را اثبات می کند.
با این حال، دو مطالعه هیچ تفاوتی در فعالیت میکروبی کشنده گلوتارالدهید های قلیایی و اسیدی مشاهده نکردند. استفاده از راه حل های مبتنی بر گلوتارآلدئید در مراکز بهداشتی درمانی به دلیل مزایای آن ها از جمله خواص بیواکسیدانی عالی، بسیار گسترده است مانند کاربردها در حضور ماده آلی (۲۰٪ سرم گاوی) و عمل غیر خورنده ای به تجهیزات آندوسکوپی، دماسنج ها، لاستیک یا تجهیزات پلاستیکی به وفور در مراکز بهداشتی مورد استفاده قرار می گیرند.
کاربردهای ضدعفونی کننده گلوتارآلدهید در ضدعفونی تجهیزات زشکی
ضدعفونی کننده گلوتارآلدئید یک ماده ضد عفونی کننده سطح بالا برای تجهیزات پزشکی از جمله آندوسکوپ، لوله اسپیرومتری، دیالیزر، مبدل، بیهوشی و تجهیزات تنفسی، استفاده از سیستم های متناسب با همودیالیز و سیستم های انتقال دیالیز و در استفاده مجدد از پلاستیک یکبار مصرف مورد استفاده قرار می گیرد.
گلوتارآلدهید برای فلز خورنده نیست و به تجهیزات لنز، لاستیک یا پلاستیک آسیب نمی رساند. گلوتارآلدئید را نباید برای تمیز کردن سطوح غیر بحرانی استفاده کرد زیرا بسیار سمی و گران است. به نظر می رسد کولیت در اثر قرار گرفتن در معرض گلوتارآلدئید از محلول ضد عفونی کننده باقیمانده در کانال های محلول آندوسکوپی گزارش شده است و با شستشوی دقیق آندوسکوپ قابل پیشگیری است.

یک مطالعه نشان داد که سطح گلوتارآلدئید باقیمانده بالاتر و متغیرتر از ضد عفونی دستی (<0.2 میلی گرم در لیتر تا ۱۵۹.۵ میلی گرم در لیتر) نسبت به بعد از ضد عفونی خودکار (۶/۶ تا ۳/۳ میلی گرم در لیتر) می باشد. به همین ترتیب، کراتوپاتی و جبران خسارت قرنیه توسط ابزارهای چشمی ایجاد شده که پس از خیساندن در ۲٪ ضدعفونی کننده گلوتارآلدهید به طور مناسب شستشو می شوند.
پرسنل بهداشت و درمان می توانند در هنگام پردازش تجهیزات در اتاق های با تهویه ضعیف، هنگام ریزش، ریخت و پاش، زمانیکه محلول های گلوتارآلدهید فعال یا تغییر می شوند یا هنگام استفاده از حمام غوطه وری باز در معرض سطوح بالای بخار گلوتارآلدهید قرار بگیرند.
قرار گرفتن در معرض حاد یا مزمن می تواند منجر به تحریک پوست یا درماتیت پوستی، تحریک غشای مخاطی (چشم، بینی، دهان) یا علائم ریوی شود. همچنین در مورد کارکنان مراقبت های بهداشتی که در معرض گلوتارآلدئید قرار دارند، اپیستاکسیس، درماتیت تماسی آلرژیک، آسم و رینیت نیز گزارش شده است.
آزمایش عملکرد ضدعفونی کننده گلوتارآلدئید در چهار مرحله
برای اطمینان از محیط کار ایمن باید سطح در معرض ضدعفونی کننده گلوتارآلدهید مورد پایش قرار گیرد. آزمایش با چهار روش انجام میشود: لوله کروماتوگرافی گازی سیلیس ژل با یک آشکارساز یونیزاسیون شعلهای، دیستروپنیل هیدرازین (DNPH) کاست فیلتر شنی تصفیه شده / کروماتوگرافی مایع با کارایی بالا (HPLC) با یک آشکارساز ماوراء بنفش (لامپ UV)، نشان غیرفعال / HPLC یا مانیتور هوا گلوتارآلدئید دستی، لوله سیلیکاژل و کاست آغشته به DNPH برای نظارت بر حد مجاز سقف ۰.۰۵ ppm مناسب هستند.
نشان منفعل با حد مجاز ۰.۰۲ ppm برای تشخیص ، در سطح سقف شورای آمریکایی بهداشت کارگران صنعتی دولت (ACGIH) در نظر گرفته می شود. سطح سقف بسیار نزدیک به حد ۰.۰۳ ppm اندازه گیری گلوتارآلدئید برای اطمینان از خواندن است. ACGIH به برنامه مانیتورینگ خاصی برای گلوتارآلدهید احتیاج ندارد. با این حال، یک برنامه نظارت برای اطمینان از سطح کمتر از حد مجاز سقف مورد نیاز است.
به عنوان مثال، نظارت باید ابتدا انجام شود تا سطح گلوتارآلدئید، پس از تغییر رویه یا تجهیزات و در پاسخ به شکایات کارگران مشخص شود. در صورت عدم وجود حد مجاز قرار گرفتن در معرض OSHA، اگر سطح گلوتارآلدهید بالاتر از حد مجاز ACGIH 0.05 ppm باشد، عمل اصلاحی و نظارت مکرر محتاطانه خواهد بود.

کنترل های فنی و مهندسی و عملی که می توانند برای رفع این مشکلات استفاده شوند عبارتند از: هودهای تخلیه مجرا، سیستم های هوایی که ۷ تا ۱۵ ساعت مبادله هوا را در هر ساعت دارند، هودهای بخاری بدون لوله با جاذب هایی برای جذب بخار گلوتارآلدئید، درب های محکم روی وان های غوطه وری، شخصی انجام می دهند.
محافظت (به عنوان مثال، دستکش لاستیکی نیتریل یا بوتیل، دستکش لاتکس، عینک طبیعی) برای به حداقل رساندن تماس پوستی یا مخاطی و پردازنده های آندوسکوپ خودکار است. اگر کنترل های مهندسی نتوانند سطح زیر سقف مجاز را حفظ کنند، موسسات می توانند استفاده از دستگاه تنفس را در نظر بگیرند (به عنوان مثال، دستگاه تنفس نیمه صورت با کارتریج بخار ارگانیک یا یک دستگاه تصفیه هوا از نوع “C” با یک جبهه کامل که در حالت فشار مثبت عمل می کند).
به طور کلی، کنترل های مهندسی نسبت به تمرین و کار و کنترل های اداری ارجحیت دارند، زیرا نیازی به مشارکت فعال کارگر مراقبت های بهداشتی نیست. حتی اگر اجرای حد مجاز سقف OSHA در سال ۱۹۹۳ توسط دادگاه تجدید نظر ایالات متحده به حالت تعلیق درآمده باشد، محدود کردن قرار گرفتن در معرض کارمندان در حد ۰.۰۵ ppm (مطابق با ACGIH) محتاطانه است.
زیرا در این سطح، گلوتارآلدئید می تواند چشم، گلو و بینی را تحریک کند. اگر دفع گلوتارآلدئید از طریق سیستم فاضلاب بهداشتی محدود باشد، می توان از بیسولفات سدیم برای خنثی کردن ضدعفونی کننده گلوتارآلدهید و ایمن سازی آن برای دفع استفاده کرد.
عملکرد میکروب زدایی گلوتارآلدهید ناشی از آلکیلاسیون
عملکرد میکروب زدایی گلوتارآلدهید ناشی از آلکیلاسیون آن در گروه های سولفیدیدریل، هیدروکسیل، کربوکسیل و آمینو میکروارگانیسم ها است که باعث تغییر RNA ، DNAو سنتز پروتئین می شود. مکانیسم عملکرد گلوتارآلدئیدها بطور مفصل در جای دیگر بررسی می شود.
غیرفعال شدن آزمایشگاهی میکروارگانیسم ها توسط گلوتارآلدئیدها به طور گسترده مورد بررسی قرار گرفته است. محققان متعددی نشان دادند که محلولهای آبی ۲٪ گلوتارآلدئید، بافر با pH 7.5-8.5 با بیکربنات سدیم به طور موثری باکترهای رویشی را کمتر از ۲ دقیقه از بین می برد.
سل، قارچ و ویروس در طی ۱۰ دقیقه و اسپور گونه های باسیلوس و کلستریدیوم در ۳ ساعت، اسپورهای C.difficile با گلوتارآلدئید ۲٪ سریعتر از سایر اسپورهای گونه های دیگر کلستریدیوم و باسیلوس از بین می روند. میکروارگانیسم هایی با مقاومت قابل توجهی در برابر گلوتارآلدئید گزارش شده است.
از جمله برخی از مایکوباکتری ها (M.chelonae ،Mycobacterium avium-intracellulare ،M.xenopi Methylobacterium mesophilicum)، Trichosporo، اسپور قارچ ها (به عنوان مثال، Microoice cinereus ،Cheatidumium Globosum) و کرایپتواسپوریدیم M.chelonae در محلول گلوتارآلدئید ۰.۲٪ آزمایش شده اند.
دو درصد محلول میکروب زدایی گلوتارآلدهید قلیایی ۱۰ به توان ۵ سلول سل را در ۵ دقیقه در دمای ۱۸ درجه سانتیگراد در سطح پنسیلواندرها غیرفعال می کند. با این حال، مطالعات بعدی توانایی مایکوباکتریایی گلوتارآلدئیدها را زیر سوال برد. گلوتارآلدئید قلیایی دو درصد، (۲۰ تا ۳۰ دقیقه) در برابر سلول سل است در مقایسه با الکل ها، فرمالدئیدها، ید و فنل دارای عملکرد آهسته تری است.

مکانیزم میکروب زدایی گلوتارآلدهید غیرفعال
سوسپانسیون سلول های M.avium ،M.intracellulare و M.gordonae در اثر غیرفعال شدن توسط گلوتارآلدهید قلیایی ۲٪ قلیایی (زمان تخمین زده شده برای تکمیل غیرفعال کردن: ۶۰ دقیقه تخمین زده شده) نسبت به بیماری سل توبرکلی مقاوم بودند (زمان تخمین زده شده برای تکمیل غیرفعال کردن ۲۵ دقیقه).
میزان کشندگی به طور مستقیم با دما متناسب بود و سوسپانسیون استاندارد از سل نمی تواند ظرف ۱۰ دقیقه استریل شود. طبق استاندارد FDA یک استریل شیمیایی پاک شده که حاوی ۲.۵٪ گلوتارآلدئید است از درجه حرارت بالا (۳۵ درجه سانتیگراد) برای کاهش زمان لازم برای دستیابی به ضد عفونی سطح بالا (۵ دقیقه) استفاده می کند ، اما استفاده از آن محدود به پردازنده های خودکار آندوسکوپ مجهز به بخاری است.

در یک مطالعه دیگر با استفاده از فیلترهای غشایی برای اندازه گیری فعالیت مایکروباکتری کششی گلوتارآلدئید قلیایی ۲٪، در مدت زمان ۲۰ دقیقه در دمای ۲۰ درجه سانتیگراد که سوسپانسیون آزمایش ۱۰ به توان ۶ مایع سل در هر غشا بود، غیرفعال شدن کامل انجام شد.
محققان متعددی نشان داده اند که محلول های گلوتارآلدئید ۲.۴ تا>5.0 log10 از توبرکلوزیس را در ۱۰ دقیقه (از جمله سلول های مقاوم به چند دارو سل) و log10 4.0-4.4 از M.tub را در ۲۰ دقیقه غیرفعال می کنند. بر اساس این داده ها و مطالعات دیگر ، ۲۰ دقیقه در دمای اتاق حداقل زمان قابل اعتماد قرار گرفتن در معرض مورد نیاز برای از بین بردن مایکو باکتری ها و سایر باکتری های رویشی با گلوتارآلدئید ۲٪ است.
نکات مهم در مورد میکروب زدایی با گلوتارآلدهید
میکروب زدایی گلوتارآلدئید معمولاً در طول استفاده رقیق می شود و مطالعات نشان می دهد که پس از چند روز استفاده در واشر اتوماتیک آندوسکوپ، میزان غلظت گلوتارآلدئید کاهش می یابد. این کاهش به دلیل خشک نشدن ابزار انجام می شود و آبی با دستگاه همراه است، باعث افزایش حجم محلول می شود و غلظت مؤثر آن را رقیق می کند. این امر بر لزوم اطمینان از ضد عفونی بودن تجهیزات نیمه غلظت گلوتارآلدئید تأکید می کند.
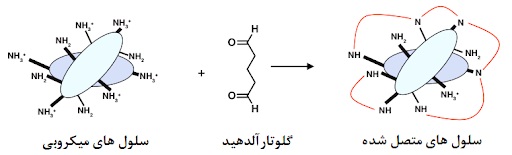
داده ها حاکی از آن است که گلوتارآلدئید ۱-۱.۵٪ حداقل محلول گلوتارآلدئید۲٪ هنگامی که به عنوان یک ماده ضد عفونی کننده سطح بالا مورد استفاده قرار می گیرند ، حداقل غلظت مؤثر است. نوارهای آزمایش شیمیایی یا مانیتورهای شیمیایی مایع برای تعیین اینکه آیا غلظت مؤثر گلوتارآلدئید با وجود استفاده مکرر و رقت وجود دارد ، در دسترس هستند.
فراوانی آزمایش باید براساس میزان استفاده مکرر از محلول ها باشد (به عنوان مثال، روزانه مورد استفاده قرار می گیرد ، روزانه از آزمون استفاده می شود ؛ هفتگی مورد استفاده قرار می گیرد ، آزمون قبل از استفاده؛ ۳۰ بار در روز استفاده می شود ، هر ۱۰ استفاده را امتحان کنید) اما از نوارها نباید استفاده شود.
طول عمر مصرف را بیش از تاریخ انقضا تمدید کنید. داده ها حاکی از آن است که مواد شیمیایی موجود در نوار تست با زمان خراب می شوند و تاریخ انقضا تولیدکننده باید روی بطری ها قرار گیرد. بطری نوارهای آزمایشی باید هنگام باز شدن و استفاده برای مدت زمان مشخص شده در بطری (مثلاً ۱۲۰ روز) تاریخ گذاری شود. نتایج حاصل از نظارت بر نوار تست باید مستند باشد.
کیت های آزمایش میکروب زدایی گلوتارآلدهید از قبل برای صحت و دامنه مورد ارزیابی قرار گرفته اند ، اما قابلیت اطمینان مورد سوال قرار گرفته است. برای اطمینان از وجود حداقل غلظت موثر مواد ضد عفونی کننده سطح بالا ، تولید کنندگان برخی از نوارهای تست شیمیایی استفاده از روشهای کنترل کیفیت را برای اطمینان از عملکرد صحیح نوارها توصیه می کنند. اگر سازنده نوار تست شیمیایی یک روش کنترل کیفیت را توصیه می کند ، کاربران باید توصیه های سازنده را رعایت کنند.

گلوتارآلدئید %۲ – فنل%۷.۰۵ – سدیم فنات ۱.۲% به عنوان محصول حاوی گلوتارآلدهید ۰.۱۲۵% – فنول ۰.۴۴%- سدیم فنات ۰.۰۷۵% هنگام رقیق شدن با نسبت ۱:۱۶یک ماده ضد عفونی کننده سطح بالا تلقی نمی شود زیرا در صورت حضور مواد آلی عدم فعالیت ضد باکتری وجود دارد و همچنین فاقد فعالیت های سل، قارچ کش، ضد ویروس و فعالیت اسپور کش است.
در دسامبر ۱۹۹۱، EPA به دلیل داده های اثربخشی نشان داد که این محصول در برابر اسپورها و احتمالاً سایر میکروارگانیسم ها یا اشیاء بی جان مطابق برچسب ادعا شده عمل نمی کند، بنابراین دستور توقف فروش کل دسته های این محصول را صادر کرد. FDA کنسانتره گلوتارآلدهید فنل / فنات را به عنوان یک ماده ضد عفونی کننده سطح بالا که حاوی ۱.۱۲٪ گلوتارآلدئید با ۱.۹۳٪ فنل / فنات در غلظت استفاده از آن است، تایید کرده است. سایر استریل های گلوتارآلدئید تایید شده توسط استاندارد FDA حاوی ۲.۴٪ -۳.۴٪ گلوتارآلدئید هستند.